La terapia génica es la introducción de material genético en una célula con el propósito de aliviar o eliminar un proceso patológico. Si bien suena como algo novedoso, la terapia génica lleva más de cuarenta años siendo objeto de investigación. En un principio la técnica fue planteada para tratar enfermedades genéticas hereditarias, sin embargo, en la actualidad tiene potencial para un mayor número de enfermedades.
Los criterios para seleccionar una enfermedad humana como candidata para el tratamiento con terapia génica son:
- La enfermedad amenaza gravemente la vida del paciente.
- Los órganos, tejidos y tipos celulares afectados por la enfermedad han de estar bien caracterizados.
- Hay una versión normal del gen defectuoso aislada y clonada.
- El gen normal puede ser introducido en una fracción significativa de células del tejido afectado o bien, la introducción del gen en un tejido accesible.
- El gen puede expresarse adecuadamente, generando una cantidad suficiente de proteína normal.
Las enfermedades que más garantía de éxito presentan para la terapia génica, en la actualidad, son las monogénicas. Se trata de enfermedades hereditarias caracterizadas por mutaciones en un único gen que comprenden trastornos muy diversos como son muchas enfermedades metabólicas, hemofilias, retinopatías del ojo o inmunodeficiencias. Como consecuencia de este gen defectuoso no se sintetiza una proteína específica o bien se produce una proteína anormal. En muchas de estas enfermedades no se dispone de una farmacoterapia convencional eficaz. El problema podría resolverse si se suministrara una copia normal del gen defectuoso a los tejidos afectados, de forma que la proteína podría ser sintetizada dentro de las células utilizando las vías celulares habituales.
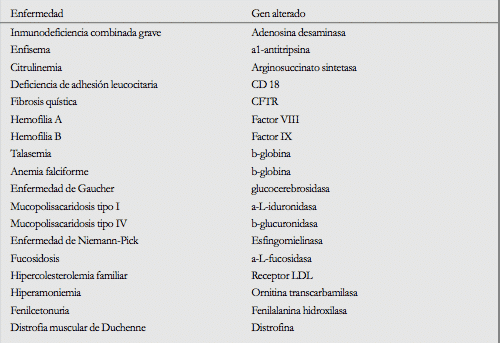
En la tabla podemos observar enfermedades monogénicas en las que se aplican protocolos clícnicos de terapia génica.
El cáncer o las enfermedades neurodegenerativas están también en el punto de mira debido a su alta prevalencia. En el caso concreto del cáncer, no se trata de corregir un defecto genético sino de utilizar la manipulación génica para dotar de una nueva propiedad relacionada con la patología oncológica con fines terapéuticos. Al ser enfermedades multigénicas el desarrollo y aplicación de la terapia con genes son más lentos y complicados.
La terapia génica tuvo inicialmente una gran aceptación por parte del público pero varios episodios en los 90 frenaron en gran medida su avance debido a la retirada de financiación en varios programas. Entre estos episodios podemos encontrar la muerte de Jess Gelsinger, un joven de 18 años que sufría una deficiencia de la enzima ornitina transcarbamilasa (esta enfermedad genética afecta al ciclo de la urea). A Jess Gelsinger se le introdujo una dosis relativamente alta de DNA, que portaba el gen que produce la síntesis correcta de la enzima, mediante un adenovirus. Se produjo una fuerte respuesta inmune a causa del adenovirus, lo que provocó un fallo multiorgánico y la muerte cerebral del paciente. Además, pocos años después aparecieron casos de leucemia en varios niños tratados con terapia génica para la inmunodeficiencia. Esto ocurrió debido a que los vectores de primera generación eran tan potentes que no solo activaban el gen terapéutico, sino que también activaban genes adyacentes y si estaban junto a regiones patogénicas del genoma se podía iniciar una leucemia. Hoy en día gracias a los avances realizados se han podido tratar más de 200 pacientes, a lo largo de una década, sin que se haya producido ningún caso adverso.
Las principales formas de actuación de la terapia génica son:
- Complementar o sustituir un gen defectuoso.
- Inhibir el funcionamiento de los genes implicados en la enfermedad.
- Inducir a la célula para que sintetice proteínas con efecto terapéutico.
Tipos de terapia génica
En función del tipo celular al que dirigimos el tratamiento, encontramos dos tipos de terapia génica:
- Terapia génica de células germinales es aquella que modifica la dotación genética de las células implicadas en la formación de gametos, transmisible a la descendencia. En humanos, esta técnica aún no ha sido practicada debido a las limitaciones tecnológicas de manipulación de células germinales y a consideraciones éticas.
- Terapia génica somática es aquella que modifica la dotación genética de células no germinales, las células somáticas o constituyentes del organismo, no transmisible a la descendencia. Este tipo de terapia génica no ha sido motivo de debates éticos, salvo su posible aplicación a la ingeniería genética de la potenciación.
Por otro lado, si tenemos en cuenta la estrategia aplicada, podemos clasificar la terapia génica en:
- Terapia génica in vivo son aquellas técnicas donde el material genético se introduce directamente en las células del organismo, sin extracción ni manipulación in vitro. Su gran ventaja respecto a la in vitro es su sencillez. En cambio, el grado de control sobre el proceso de transferencia del DNA exógeno a la célula es menor, la eficiencia global es menor también y es difícil conseguir un alto grado de especificidad tisular.
- Terapia génica ex vivo son aquellos protocolos en los que las células a tratar son extraídas del paciente, aisladas, crecidas en cultivo y sometidas al proceso de transferencia in vitro. Una vez seleccionadas las células dotadas del DNA exógeno, se expanden en cultivo y se introducen de nuevo en el paciente. Las principales ventajas abarcan la elección del tipo de células a tratar, el mantenimiento del control sobre el proceso y una mayor eficacia en la introducción del DNA exógeno en la célula. Los problemas más notables son la mayor complejidad, el coste de los protocolos y la imposibilidad de introducir DNA exógeno en tejidos que no son susceptibles de crecer in vitro.
Existe un gran número de barreras presentes en el organismo que pueden impedir que el DNA llegue a la célula. Para proteger los genes se usan vehículos o vectores. Hay dos grandes grupos de vectores: virales y no-virales. Los vectores virales incluyen todos aquellos que se han obtenido a partir de un virus. A estos vectores se les eliminan sus características patológicas y se adaptan como transportadores de material genético. Se aprovecha la ventaja que aportan los virus como vectores naturales, ya que han sufrido procesos de evolución a lo largo de millones de años para optimizar su función de introductores de material genético en las células que invaden. Denominamos transducción al proceso de transferencia de DNA exógeno a una célula mediante un vector viral. Los vectores no-virales siguen una estrategia opuesta: síntesis en lugar de modificación. Parten de estructuras sencillas y conocidas e intentan construir un sistema completamente artificial que posibilite el transporte efectivo de genes en el interior de una célula.
Algunos de los vectores virales más empleados:
– Vectores retrovirales: los retrovirus son virus envueltos, cuyo ácido nucleico es el RNA. Sus principales ventajas son que no inducen inmunidad e integran su material genético dentro del genoma celular. Por otra parte, muchos de ellos únicamente pueden introducir el DNA en células que se están dividiendo y pueden inducir mutaciones no esperadas (“mutagénesis por inserción”).
– Vectores adenovirales: virus sin envoltura con un genoma bicatenario cuyo ácido nucleico es el DNA. Transducen en células que no están en división y no se integran en el genoma, por lo que no hay riesgo de mutagénesis por inserción. Sin embargo, su expresión es temporal y corta debido a que provoca respuesta por parte del sistema inmunitario.
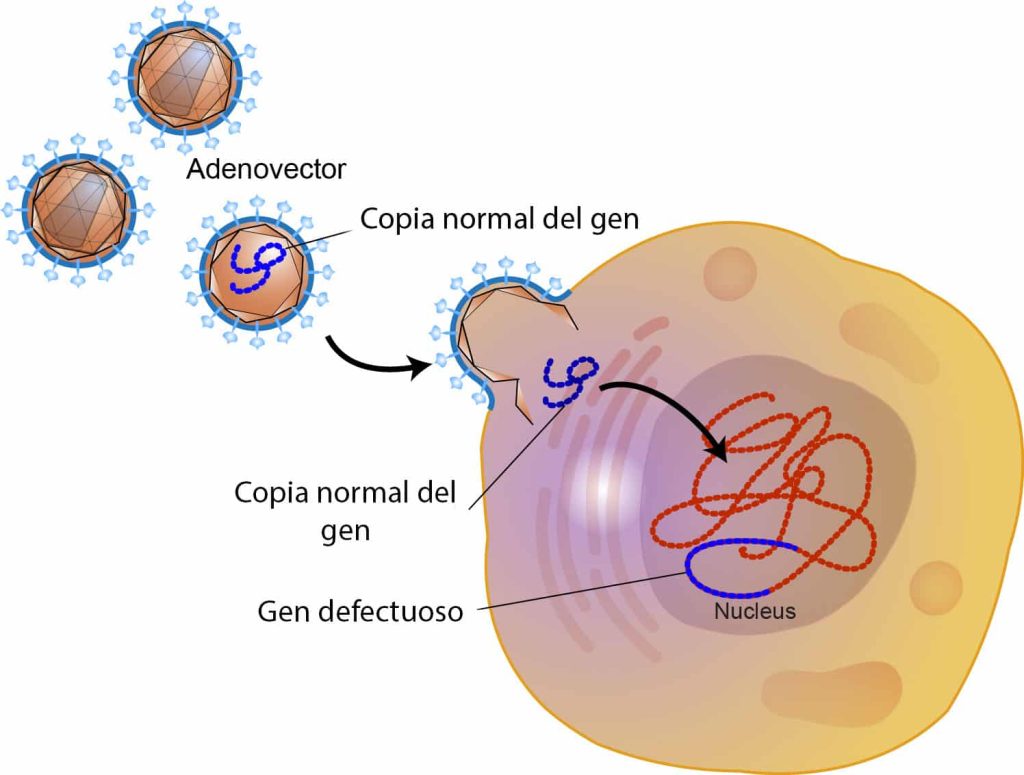
– Vectores asociados en virus adenosasociados: parvovirus humanos no patológicos. Su punto fuerte es que no producen enfermedad en humanos, por lo que no hay respuesta inmune. Su principal desventaja es que el tamaño de DNA a introducir es muy limitado.
– Vectores virales quiméricos: combinación de varios vectores para compensar las limitaciones que presentan cada uno por separado, a la vez se aprovechan las ventajas más destacables que aportan individualmente.
Los métodos o vectores libres de virus más usados en terapia génica son:
– Métodos físicos: introducción de DNA en la célula mediante la aplicación de un sistema mecánico o eléctrico. Presentan claras limitaciones por su aplicación local y el número reducido de células que afectan. Los principales métodos son la microinyección, bombardeo de partículas, electroporación de alto voltajes e inyección intersticial de DNA libre.
– Liposomas catiónicos (Lipoplexes): Se emplean lípidos catiónicos (cargados positivamente) para encapsular DNA. Presentan niveles de eficacia aceptablemente altos, inmunogenicidad casi nula, capacidad de transporte de DNA sin restricción de tamaño, gran estabilidad de almacenaje y sencillez de uso. Sin embargo, son difíciles de caracterizar estructuralmente y no presentan especificidad celular.
– Quimeras HVJ-liposomas (virosomas): liposoma quimérico obtenido por la fusión con el virus HVJ. Se combinan las ventajas del vector no viral con la capacidad de unión celular y la facilidad de fusión aportadas por las proteínas de la envuelta vírica.
– Conjugados moleculares (poliplexes): moléculas bifuncionales obtenidas por unión covalente entre un policatión que posibilita la unión y condensación de DNA, junto con un ligando o anticuerpo monoclonal que confiere especificidad celular. Estas moléculas forman complejos con DNA de estructura definida que permite su fácil captura por la célula, siguiendo una ruta endocítica mediada por receptor.
– Policationes (poliplexes): complejo policatión-DNA. Permite la interacción con el DNA, su condensación y la interacción de los complejos resultantes con las membranas celulares.
– Vectores de naturaleza peptídica (peptiplexes): los dos tipos principales son los que emplean proteínas multidominio (basadas en el carácter modular de las toxinas bacterianas) y péptidos modulares (aplicación de péptidos con funcionalidades específicas).
Los obstáculos que impiden el éxito clínico de la terapia génica tienen que ver más con las herramientas que con sus fundamentos. Aunque existe una gran variedad de vectores que presentan diversas ventajas e inconvenientes, ninguno de ellos alcanza el nivel de calidad requerido para que la terapia génica obtenga la madurez que le permita ser una alternativa real y competitiva frente a las terapias tradicionales. Cabe tener en cuenta, además, los elevados costes que implican los ensayos clínicos ya que, al tratarse de enfermedades minoritarias, se reclutan pocos pacientes. Además, como el número de personas al que están dirigidas es muy pequeño, ofrece pocas motivaciones a las empresas comercializadoras. Es un tratamiento muy costoso que incluso ha provocado la retirada del mercado de un fármaco aprobado en 2012, Glybera, debido a que su precio rondaba el millón de euros y corregía una enfermedad muy rara en niños. Según opinan algunos científicos: “Estamos ante un potencial éxito terapéutico y un gran fracaso comercial”.
Bibliografía:
- Cayón Somacarrera, S. (2017). Terapia génica: estado actual y perspectivas.
- Ruiz Castellanos, M., & Sangro, B.. (2005). Terapia génica: ¿Qué es y para qué sirve?. Anales del Sistema Sanitario de Navarra, 28(1), 17-27.
- Bueren, J., Montellón, J.L. (2007). Curso de biotecnología aplicada, Madrid, España, Saned 2007.
- Wang, D., Gao, G. (2014). State-of-the-art human gene therapy: Part II. Gene therapy strategies and aplications. Discover Med., 18(98), 151-161.
- https://ghr.nlm.nih.gov/primer/therapy/genetherapy (14 de noviembre, 2017).
Si te ha gustado este blog y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos (¡tenemos uno de Terapia Génica!) y formación universitaria.