Carlos Manuel Cuesta Díaz
¿Alguna vez te has preguntado por qué tu prima Felipina aguanta peor el alcohol que tu tío Jacobo? Pues posiblemente sea porque tu prima tiene 20 años y pesa 50 kilos, y tu tío pesa 120 kilos y lleva 30 años siendo alcohólico crónico. Pero en otros casos la razón de la tolerancia, o, mejor dicho, su falta, no es tan evidente, y una de las causas puede estar en la genética.
Metabolismo del alcohol en cómodos fascículos
El metabolismo del alcohol es un proceso complejo que vamos a simplificar para llegar a nuestro punto. Aproximadamente el 90% del alcohol ingerido es metabolizado por el hígado. En condiciones normales, más del 90% del alcohol que alcanza el hígado se degrada mediante la enzima alcohol deshidrogenasa (ADH), una proteína en los hepatocitos, que es donde nos centraremos. Esta enzima transfiere el hidrógeno del grupo OH a una molécula de NAD, convirtiendo el alcohol en acetaldehído, una sustancia de mayor toxicidad.
Afortunadamente, el hepatocito intenta hacer rápido su trabajo y usando una segunda enzima, el aldehído deshidrogenasa (ALDH), el acetaldehído se convierte en acetato que suele incorporarse al ciclo de Krebs como acetil coenzima A. O dicho de otra forma, se vuelve inofensivo para el organismo en cantidades normales. Se piensa que la ALDH oxida más del 90% del acetaldehído producido en la oxidación del alcohol, principalmente la ALDH2, la más eficiente.
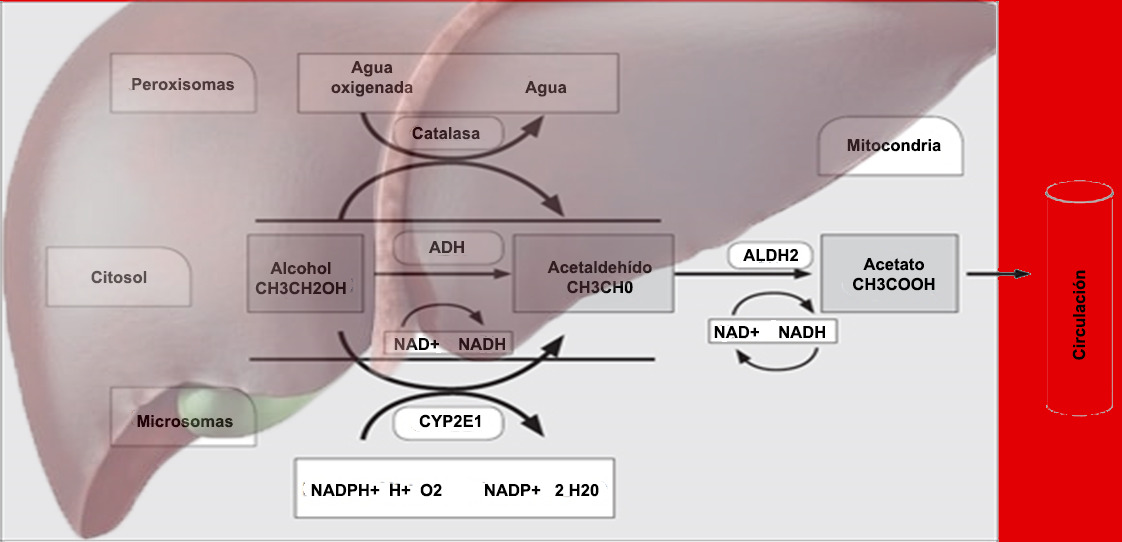
Con el hígado haciendo el 90% de la degradación del alcohol, la ADH haciendo el 90% de dicha degradación en el hígado, y la ALDH el 90% de la degradación del acetaldehído resultante (90 es número de la suerte hoy) podemos entender que cualquier mutación en los genes de estas enzimas y sus variantes va a tener efectos importantes cuando se consumen bebidas alcohólicas.
Otro detalle es que la ADH es un dímero. ¿Qué quiere decir que una proteína es un dímero? Que se encuentra formada por dos macromoléculas, si son iguales es homodímero, si son distintas, heterodímero. ¿Por qué os cuento esto? Porque a la genética le gusta complicar las cosas.
La ADH no es un enzima, si no varias isoenzimas
Como en la variedad está el gusto, la ADH en el hígado humano es codificada por hasta 7 genes distintos, localizados en el cromosoma 4q22, encontrándose la enzima por tanto en múltiples formas.
Las llamadas ADH Clase I son las principales encargadas de la oxidación del alcohol, sobre un 70%, y se trata de tres genes, ADH1A, ADH1B, y ADH1C. Sin embargo, aunque son tres genes, contienen información para varias subunidades. Cada subunidad es una de las dos macromoléculas que se unen para formar la enzima final funcional. Mientras que el gen ADH1A es modesto y solo produce la subunidad α, el gen ADH1B codifica tres subunidades, β1, β2 y β3, mientras que la ADH1C las subunidades γ1 y γ2. Es decir, en tres genes tenemos información para SEIS SUBUNIDADES. Y, por si fuera poco, TIENEN LA CAPACIDAD DE FORMAR HETERODIMEROS. El resto de ADHs tienen la amabilidad de formar solo homodímeros.
El gen ADH4 produce la subunidad π, que se juntan formando una enzima ALDH con dos homodímeros ππ, siendo junto a las tres anteriores la otra isoenzima que colabora en la eliminación del alcohol de forma relevante.
La ADH5 produce la subunidad χ y homodímeros χχ, y es la que tiene menor afinidad por el alcohol. Si la tienes funcionando, deberías dejar de beber, porque necesita concentraciones bastante elevadas.
La ADH6, aunque hay gen y RNA presentes, jamás se ha podido aislar la proteína en el organismo humano, por lo que nadie se ha molestado en darle una letra griega.
Finalmente, la ADH7 codifica la subunidad σ y es la única que no se encuentra en el hígado, sino en el estómago y el esófago. Y es muy buena oxidando retinol a retinal, una función con cero importancia ahora mismo mientras hablamos del alcohol, pero queda como curiosidad.
El resultado es una región cromosómica formada por duplicaciones génicas y llena de variaciones entre individuos de distintas poblaciones.
Por ejemplo, la isoenzima ADH1B y su alelo ADH1B*1 (β1β1) está en más del 90% de población caucásica; en cambio ADH1B*2 (β2β2) se reporta con alta frecuencia en población asiática (~70%) y ADH1B*3 (β3β3) es común en población africana (~16%).
“Vale, ya nos has aburrido, ¿A dónde quieres ir a parar?”. Pues a que no todas las enzimas ADH tienen la misma eficacia ni distribución en los individuos.
El alelo ADH1B*1 de la isoenzima ADH1B es el más frecuente en todo el mundo excepto en el Sureste Asiático. También es casualmente la que tiene la ratio más baja de metabolizar alcohol, es decir, es la que más lentamente produce acetaldehído, el principal responsable de las resacas y el malestar.
En cambio, en China y Japón es muy frecuente el ADH1B*2, que se ha comprobado in vitro que es capaz de oxidar etanol hasta 11 veces más rápido que la forma proveniente del alelo ADH1B*1. Y luego tenemos una segunda etapa en su metabolismo…
Si, la ALDH2 tampoco es una sola enzima
Tranquilos, amigos lectores, ahora solo tenemos dos isoenzimas, según el alelo, una ALDH2*1 y una ALDH2*2. La única diferencia entre ambas es una pequeña mutación en un nucleótido que provoca el cambio en la nueva proteína de un aminoácido, específicamente un glutamato por una lisina.
Y ese simple cambio hace que los individuos homocigotos para ALDH2*2/*2 tengan una ALDH2 inactiva. Su ALDH2 es incapaz de metabolizar el acetaldehído. Los heterocigotos, ALDH2*1/*2, conservan casi, casi, el 10% de la actividad. Bien por ellos.

Sin embargo, estos individuos no se reparten aleatoriamente por el mundo. El 40% de los asiáticos poseen el alelo ALDH2*2, mientras que en las poblaciones europeas y africanas es inferior al 5%.
Es decir, tenemos una cantidad importante de asiáticos que no solo producen a mayor ritmo acetaldehído, sino que además lo metabolizan en acetato a menor ritmo. El resultado es una acumulación de acetaldehído en las células, sangre y tejido, que lleva a daños y distintos síntomas, incluyendo las habituales mejillas sonrojadas.
Irónicamente, estos individuos son resistentes a desarrollar dependencia alcohólica. Cuando el alcohol dura menos tiempo en sangre, pero el acetaldehído dura más, las ganas de tomarte cuatro cervezas son breves.
Enlaces de interés:

