El gen de la esquizofrenia, el gen del lenguaje, el gen de la diabetes… ¡Incluso el gen de la infidelidad! ¿Cuántas veces hemos visto cómo los titulares reducen erróneamente enfermedades o rasgos humanos complejos a un único gen? En la primera entrada del blog comentábamos cómo genes y ambiente interaccionan para regular la manifestación de las características de un organismo. Aunque existen características o enfermedades en las que el peso principal recae sobre un único gen (por ejemplo, la fibrosis quística está causada por mutaciones en el gen CFTR), lo cierto, es que en la mayoría de los rasgos y enfermedades comunes, intervienen más de un gen y además, los factores ambientales juegan un papel importante. Otro tipo son las enfermedades complejas.
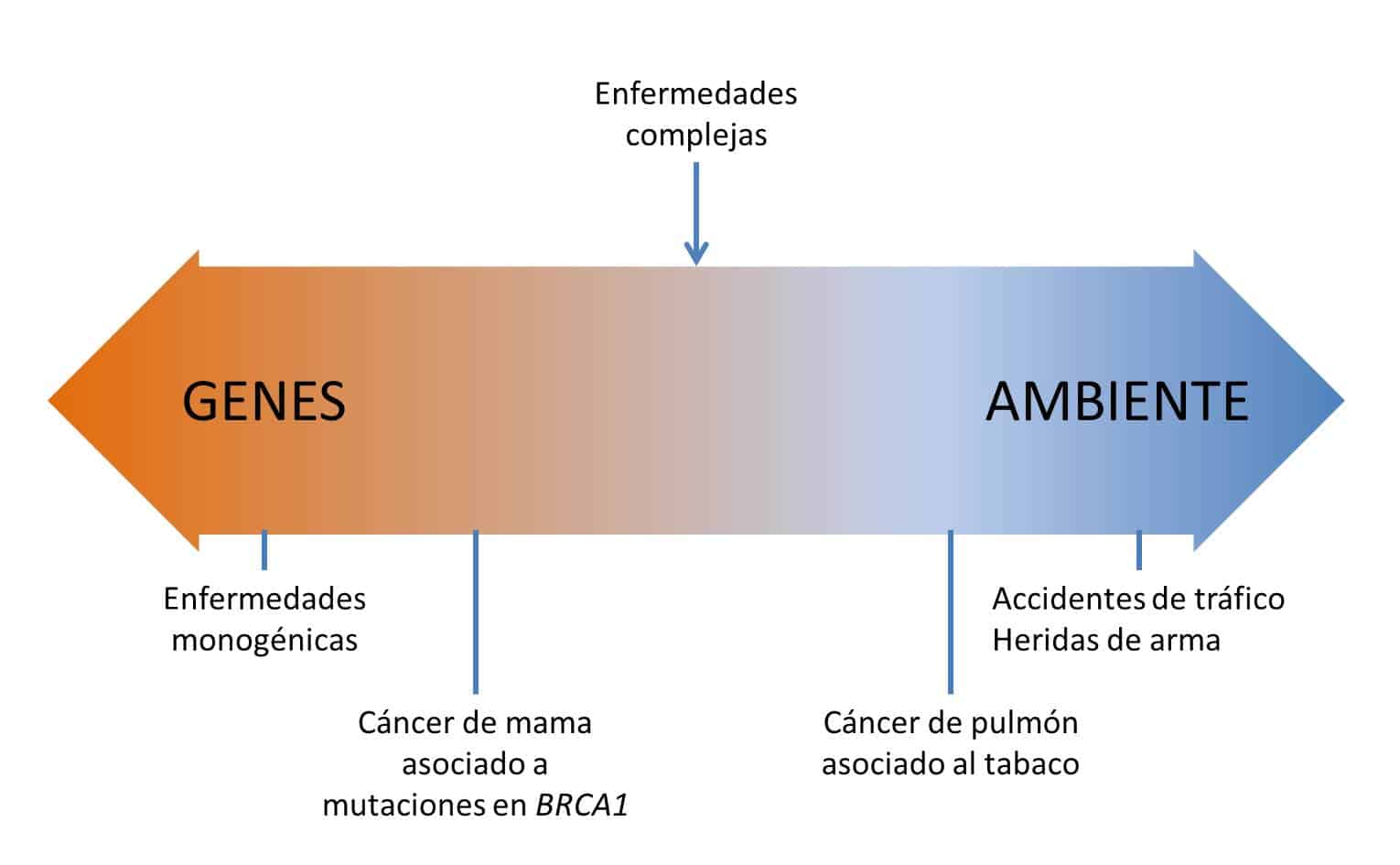
Las enfermedades complejas o multifactoriales son aquellas enfermedades que están causadas por el efecto combinado de diferentes genes y en las que además influyen los factores ambientales de forma considerable. Por sus características, estas enfermedades son difíciles de estudiar, ya que los investigadores deben identificar y estimar el peso de cada factor. Lo cual no es nada fácil.
La diabetes, la esquizofrenia, el alzhéimer, la psoriasis, la artritis reumatoide o el asma, son algunos ejemplos de enfermedades complejas.
La esquizofrenia como enfermedad compleja
Consideremos la esquizofrenia como ejemplo de enfermedad compleja. Además de la dificultad de caracterizar la esquizofrenia desde el punto de vista clínico, empezar a desentrañar los misterios de la biología y los genes que intervienen en la esquizofrenia sigue siendo hoy en día un hueso duro de roer para los investigadores.

La esquizofrenia es un trastorno psiquiátrico grave que afecta a alrededor del 1% de la población. Cuando está activa, la esquizofrenia se manifiesta en síntomas de diferentes tipos que pueden incluir delirios, alucinaciones, falta de motivación, confusión y problemas cognitivos. Algunos de los síntomas pueden ser tratados y los pacientes mejoran con el tiempo. No obstante, en la actualidad no existe una cura para la enfermedad.
Como toda enfermedad con un componente genético, la esquizofrenia muestra agregación familiar. Sin embargo, la agregación familiar no es suficiente para poder decir que algo es genético o hereditario. Muchas características que se presentan de forma agregada en las familias no están dirigidas por los genes. Como por ejemplo, el idioma. En mi familia todos hablamos español, ¿es hablar español hereditario? No. El idioma no es una característica hereditaria, sino un comportamiento social o cultural adquirido. Si hubiéramos crecido en Japón en un ambiente en el que todos los de nuestro alrededor hablaran japonés, sin duda hablaríamos japonés perfectamente, independientemente de nuestro ADN español.

Cuando se calcula el riesgo de una persona a tener esquizofrenia según la presencia de la enfermedad en los miembros de su familia, la cosa ya va apuntando a los genes como importantes protagonistas. En el caso de la esquizofrenia, las personas con un hermano gemelo idéntico (y que por tanto comparten 100% su ADN genómico) tienen un riesgo a desarrollar la enfermedad del 45%, frente al 1% de la población general. Para un hermano no gemelo, el riesgo es de 13% y cuando se tiene uno de los padres afectados, el riesgo es alrededor del 6%. Esto quiere decir que cuánto más ADN se comparte, mayor es la probabilidad de que si una persona tiene esquizofrenia, la otra también la tenga.

Por otra parte, el hecho de que a pesar de compartir el 100% de su genoma pueda ocurrir que un gemelo idéntico tenga la enfermedad y otro no, nos recuerda que además de los genes, en el desarrollo de la esquizofrenia también intervienen factores ambientales.
Sabemos que los genes participan en la esquizofrenia, pero suena un poco vago. ¿Se puede cuantificar cuánto contribuyen los genes? Sí, gracias a una expresión matemática llamada heredabilidad que mide cuánta variación de un rasgo es debida a factores genéticos. Sin entrar en detalle de cómo se calcula, la heredabilidad se estima principalmente de comparar la coincidencia de un rasgo o enfermedad entre gemelos idénticos que comparten su ADN y gemelos no idénticos que sólo comparten una proporción de su material hereditario. Pues bien, en el caso de la esquizofrenia la heredabilidad es muy alta, concretamente alrededor del 81%.
Vale, la esquizofrenia se hereda y los factores genéticos tienen un peso importante en su desarrollo. Pero, ¿dónde están los genes de la esquizofrenia?
Afortunadamente gracias a la secuenciación del genoma humano ya sabemos dónde buscar y desde hace años diferentes estudios han abordado el rastreo por arriba y abajo del ADN de los pacientes con esquizofrenia para intentar identificar a los culpables.
Curiosamente, el primer gen relacionado con la esquizofrenia fue encontrado antes de secuenciar el genoma. El gen DISC1, que recibe su descriptivo nombre de Disrupted- in-Schizophrenia 1 se identificó a partir de un punto de rotura cromosómica que se transmitía en una familia con elevada incidencia de esquizofrenia y otras enfermedades psiquiátricas. Aunque la presencia de alteraciones en el gen DISC1 no es garantía de desarrollar la esquizofrenia (seguimos hablando de una enfermedad compleja), sí aumenta considerablemente el riesgo. Estudios posteriores han encontrado más asociaciones entre el gen y la enfermedad. Además algunos estudios funcionales sugieren que DISC1 regula el esqueleto interno de la célula y podría contribuir a la esquizofrenia alterando las funciones neuronales que dependen de este esqueleto, como por ejemplo la migración, el transporte intracelular o la arquitectura de las prolongaciones nerviosas.
Después de DISC1, numerosos genes han engrosado la lista de los genes candidatos para la esquizofrenia, y han sido borrados de nuevo ante la falta de replicación o ausencia de evidencias funcionales. Sólo recientemente, gracias a los últimos estudios con ADN de miles y miles de pacientes y controles, se han encontrado asociaciones significativas entre variantes genéticas comunes y raras. Estos estudios, denominados estudios de asociación del genoma completo (o GWAS), evalúan si la frecuencia de variantes genéticas concretas es diferente en pacientes y controles. Cuando hay diferencias entre pacientes y controles para una variante genética dada, se dice que hay asociación de la variante con la enfermedad.

Aun así, encontrar una asociación significativa entre una variante genética y una enfermedad, no prueba que el gen donde se encuentra esté relacionado con la enfermedad. Hacen falta más experimentos para probar que la falta de función de un gen interviene, en mayor o menor medida en una enfermedad.
En el caso de la esquizofrenia, el primer gen identificado en un GWAS que ha podido ser relacionado funcionalmente con la enfermedad es el gen responsable de codificar el componente 4 del complemento, molécula que forma parte del sistema inmunitario innato y participa en la eliminación de patógenos y reciclaje de restos celulares. Hace apenas dos años, un estudio confirmaba la existencia de variabilidad en los genes C4 asociada a esquizofrenia, y describía cómo el gen se expresa de forma diferente en pacientes y controles y participa en el reciclaje de sinapsis nerviosas, un proceso relacionado con la pérdida de sinapsis observado con frecuencia en los pacientes.
¿Cuáles son las perspectivas de futuro en el estudio de las enfermedades complejas?
El caso de la esquizofrenia es sólo un ejemplo de la complejidad que entraña el estudio de las enfermedades multifactoriales. Afortunadamente, en los últimos años se ha avanzado mucho en dos frentes: por una parte, cada vez se conoce mejor el genoma y existen más herramientas para su análisis y por otra, las enfermedades complejas cada vez se describen mejor.
Se espera que en un futuro el análisis del genoma permita identificar todos los factores genéticos implicados en enfermedades como la esquizofrenia, diabetes o la artritis reumatoide, entre otras. Este conocimiento resultará clave para poder diseñar estrategias terapéuticas frente a estas enfermedades. Si se conocen qué moléculas o rutas biológicas intervienen se puede trabajar para desarrollar fármacos que modifiquen o bloqueen su función. Sin olvidar los factores ambientales, que también influyen e interaccionan con los factores genéticos.
La forma de abordar y hacer frente a las enfermedades complejas pasará entonces por tener en cuenta tanto los factores genéticos que participan en cada paciente como los factores ambientales para personalizar el tratamiento y/o modificar el estilo de vida si es necesario .
Bibliografía:
Birnbaum R, Weinberger DR. Genetic insights into the neurodevelopmental origins of schizophrenia. Nat Rev Neurosci. 2017 Dec;18(12):727-740. doi: 10.1038/nrn.2017.125.
Kotlar AV, et al. New discoveries in schizophrenia genetics reveal neurobiological pathways: A review of recent findings. Eur J Med Genet. 2015 Dec;58(12):704-14. doi: 10.1016/j.ejmg.2015.10.008.
Sekar A, et al. Schizophrenia risk from complex variation of complement component 4. Nature. 2016. doi: 10.1038/nature16549
Samson JN y Wong AHC. The Genetics of Schizophrenia. Drug Discovery for Schizophrenia. Doi: http://dx.doi.org/10.1039/9781782622499-00001



