A finales del siglo XX, un descubrimiento acerca de unos pequeños microorganismos sembraría la semilla de la herramienta molecular que revolucionó (y continúa revolucionando) la edición genética. Así es, me refiero a CRISPR, una “nanoherramienta” que, hasta la fecha, ha demostrado ser de utilidad en una gran batería de situaciones diferentes. ¿Quieres saber más sobre ella? ¡Continúa leyendo!
Origen y descubrimiento de CRISPR
La historia de CRISPR comienza a finales de los años 80 en el laboratorio de Yoshizumi Ishino de la Universidad de Osaka. Ishino y su equipo describieron por primera vez unas secuencias repetidas muy características en el genoma de Escherichia coli. Poco después, en 1993, el equipo de investigadores dirigido por el microbiólogo alicantino Francisco Juan Martínez Mojica identificó (de forma independiente) estas secuencias repetidas en una arquea, Haloferax mediterranei. En ese momento los dos equipos desconocían la función de estas secuencias y, por tanto, no se podían ni imaginar su gran potencial en biología molecular.
Diferentes grupos de investigadores, incluido el equipo de Mojica, continuaron investigando las secuencias repetidas y las identificaron en múltiples grupos de bacterias y arqueas, además de en el genoma mitocondrial. Fue entonces cuando el alicantino acuñó, por primera vez, el término CRISPR (siglas en inglés de “Repeticiones Palindrómicas Cortas Agrupadas Regularmente Interespaciadas”).
Poco después del descubrimiento de las secuencias CRISPR, diferentes equipos de investigadores encontraron que ciertos espaciadores de estas secuencias derivan de virus bacteriófagos o plásmidos. En ese momento, el grupo de Mojica sugirió que las secuencias CRISPR podían formar parte de algún tipo de “sistema inmunitario adaptativo” propio de los organismos unicelulares, como bacterias y arqueas. Y no se equivocaba, aunque esto no se confirmaría hasta años más tarde.
A principios del siglo XXI, múltiples equipos de investigadores intentaron descifrar los mecanismos moleculares relacionados con las secuencias CRISPR, con el objetivo de determinar cuál era realmente su función. Finalmente, en 2007, el equipo del francés Rodolphe Barrangou publicó un artículo en el que se detallaba cómo las secuencias CRISPR, junto a unas proteínas llamadas “cas”, proporcionan resistencia adquirida a infecciones pasadas en bacterias procariotas.
¿Qué es y cómo funciona CRISPR-Cas?
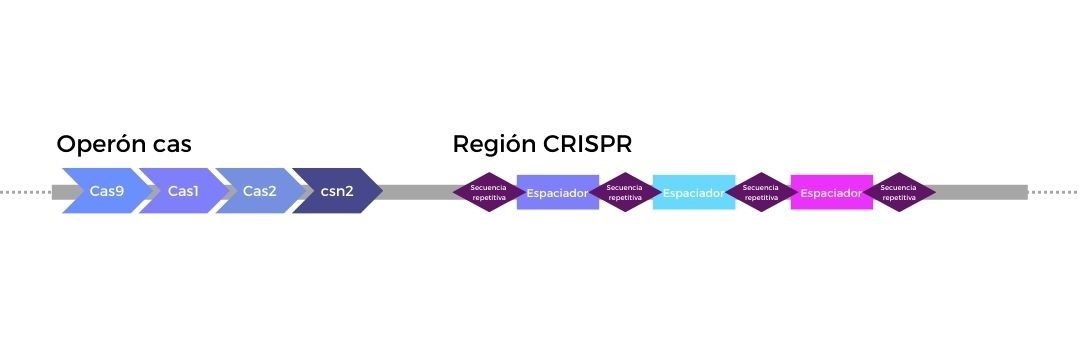
Los locus CRISPR son una serie de regiones altamente repetitivas que se encuentran presentes en el genoma de diferentes especies de bacterias y arqueas. Están formadas por dos partes diferenciadas, el operón cas y la región CRISPR. Por un lado, el operón cas contiene la información genética para codificar las endonucleasas Cas y otras proteínas relevantes para la función de CRISPR-cas. Por el otro lado, la región CRISPR está formada por secuencias repetidas intercaladas con pequeñas secuencias espaciadoras, de origen exógeno.
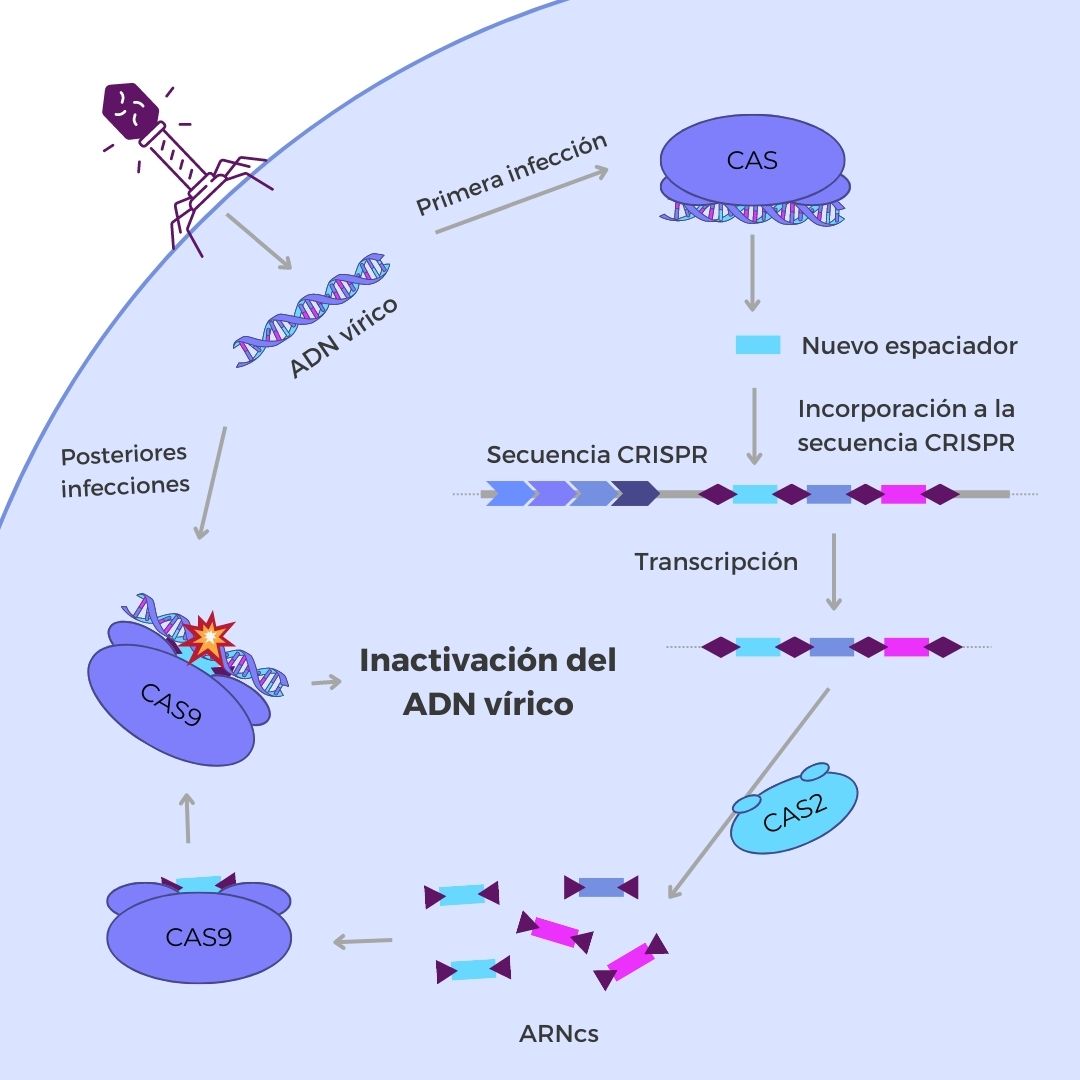
En cuanto a su funcionamiento, el sistema CRISPR-Cas es una especie de “sistema inmunitario adaptativo” que consta de varias etapas. En primer lugar, es capaz de identificar el ADN exógeno e incluirlo en su “batería” de espaciadores. Las proteínas encargadas de este primer paso son Cas1 y Cas2, proteínas capaces de identificar las secuencia de ADN exógeno, normalmente provenientes de virus bacteriófagos. Estas proteínas, además, cortan el ADN exógeno, generando un “protoespaciador”, que posteriormente será modificado e insertado en una secuencia CRISPR.
En segundo lugar, el sistema CRISPR es capaz de identificar el ADN de un virus que ya ha infectado previamente un organismo unicelular y cortarlo mediante una endonucleasa, para evitar una nueva infección. Para ello, el organismo sintetiza múltiples cadenas de ARN a partir del locus CRISPR y las proteínas cas lo separan en pequeñas moléculas de ARN con la información de un espaciador (denominadas ARNcr). Estos ARNcr se asocian a diferentes proteínas Cas y se unen al ADN del fago, interfiriendo en su ciclo de replicación. Posteriormente, las proteínas Cas cortan la secuencia de ADN exógeno, evitando la infección vírica por completo.
Tecnología CRISPR: historia y tipos
El inicio del siglo XXI comenzó la verdadera “revolución CRISPR”. Y es que el nuevo sistema de inmunidad adquirida que se había identificado en microorganismos se convirtió en una herramienta con un potencial inimaginable en biología molecular. Esto se lo debemos a una gran multitud de investigadores de todo el mundo, entre los que se encuentran las bioquímicas Emmanuelle Charpentier y Jennifer Doudna, pioneras en el campo de las tecnologías CRISPR. Juntos, sus equipos se basaron en el sistema CRISPR de las bacterias para diseñar una herramienta molecular capaz de editar las moléculas de ADN a placer, CRISPR-Cas9. Por ello, se les otorgó el Premio Nobel de Química del año 2020.
Actualmente, se han diseñado múltiples herramientas CRISPR, que pueden ser utilizadas en diferentes ámbitos de la Biología Molecular y la Genómica para lograr diferentes resultados. Las tecnologías CRISPR más conocidas en el ámbito de la Salud son:
Edición genómica por nucleasa estándar (CRISPR-Cas9):
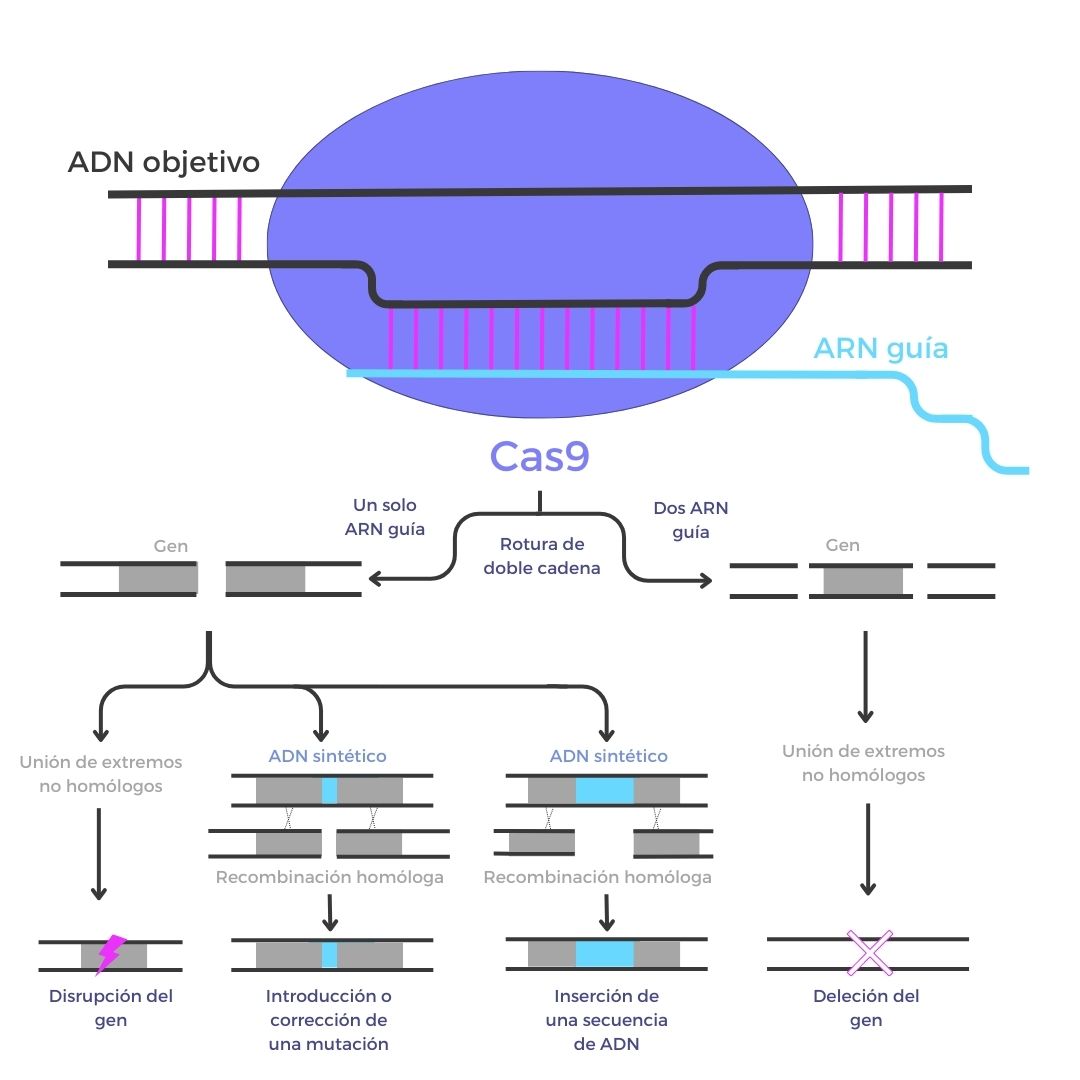
Se trata de un método de edición genómica basado en CRISPR que se fundamenta en la acción de Cas9 como nucleasa. Es capaz de cortar la molécula de ADN en sitios específicos, en base a uno o dos ARN guías específicos. Gracias a ello, puede utilizarse para corregir mutaciones, suprimir e insertar secuencias de ADN e incluso para inactivar genes concretos.
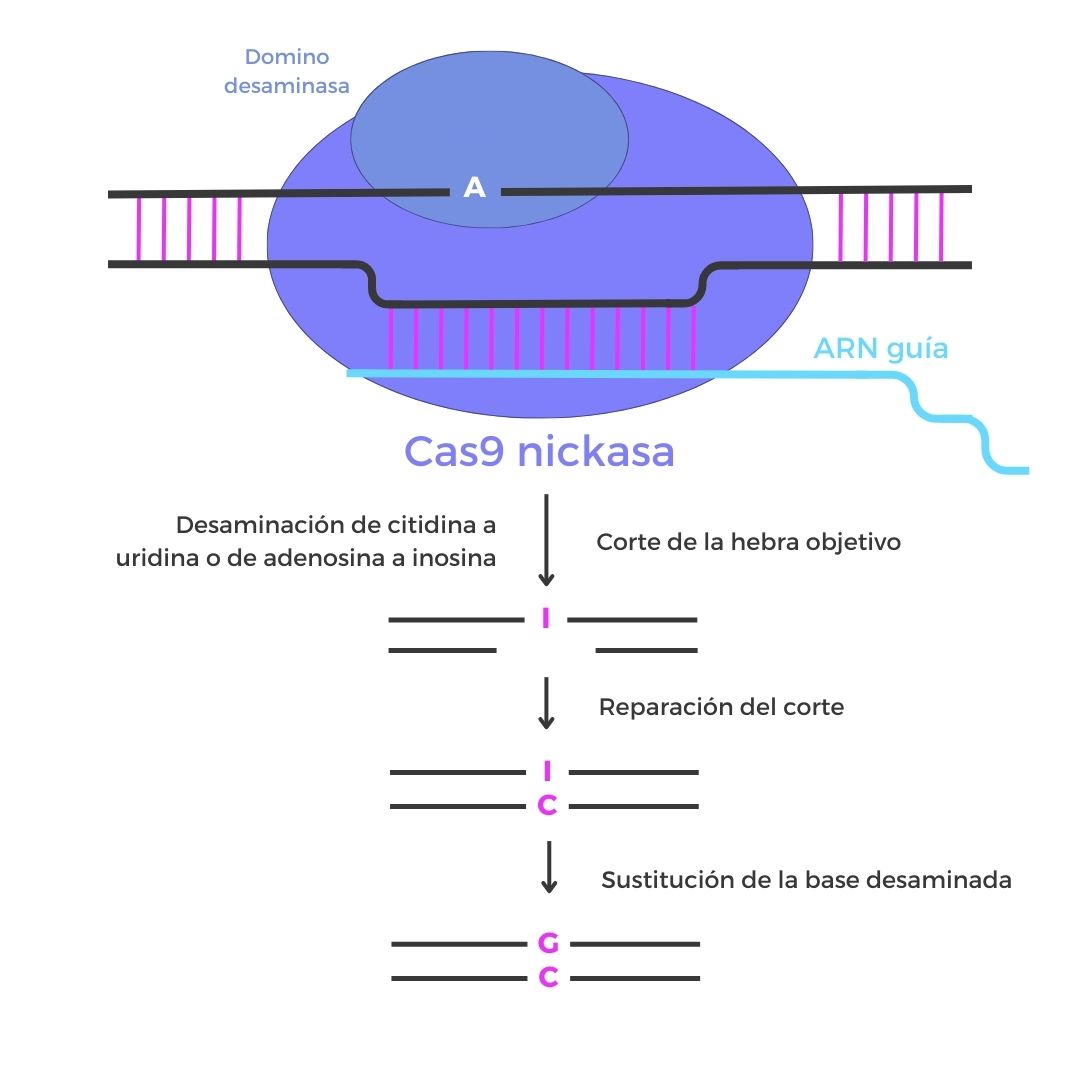
Edición de bases
Esta tecnología CRISPR permite modificar una única base nitrogenada de una molécula de ADN. Está basada en la acción de una proteína Cas9 con la función de nucleasa desactivada (no puede cortar cadenas de ADN) y un dominio adicional capaz de modificar las bases nitrogenadas.
Las tecnologías de edición de bases son una herramienta prometedora, aunque tienen ciertas limitaciones. En primer lugar, solamente pueden realizar modificaciones concretas de nucleótidos (de Citosina a Timina, de Adenina a Guanina y de Citosina a Guanina). En segundo lugar, solamente pueden actuar sobre determinadas regiones del genoma, así que, por el momento no se puede utilizar libremente sobre cualquier secuencia.
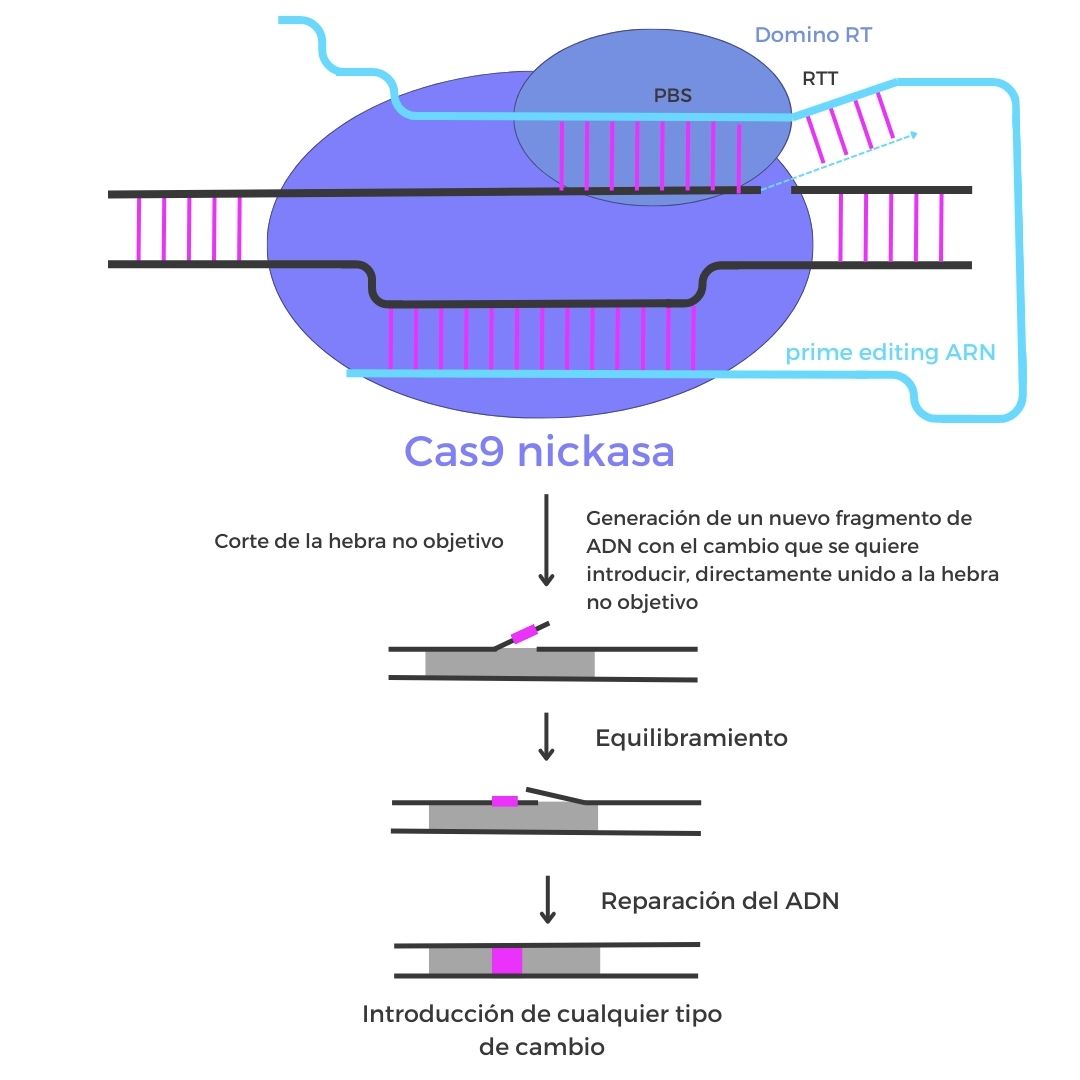
Prime editing
Esta tecnología CRISPR mantiene la precisión y la eficiencia de los editores de bases, pero eliminando algunas de sus limitaciones. Se trata de una herramienta extremadamente versátil que está basada en la acción de una proteína Cas9 modificada para que únicamente pueda cortar una de las dos cadenas de una molécula de ADN y una transcriptasa inversa. Gracias a esta tecnología, es posible tanto realizar cambios de una sola base como provocar inserciones y deleciones de diferentes tamaños.
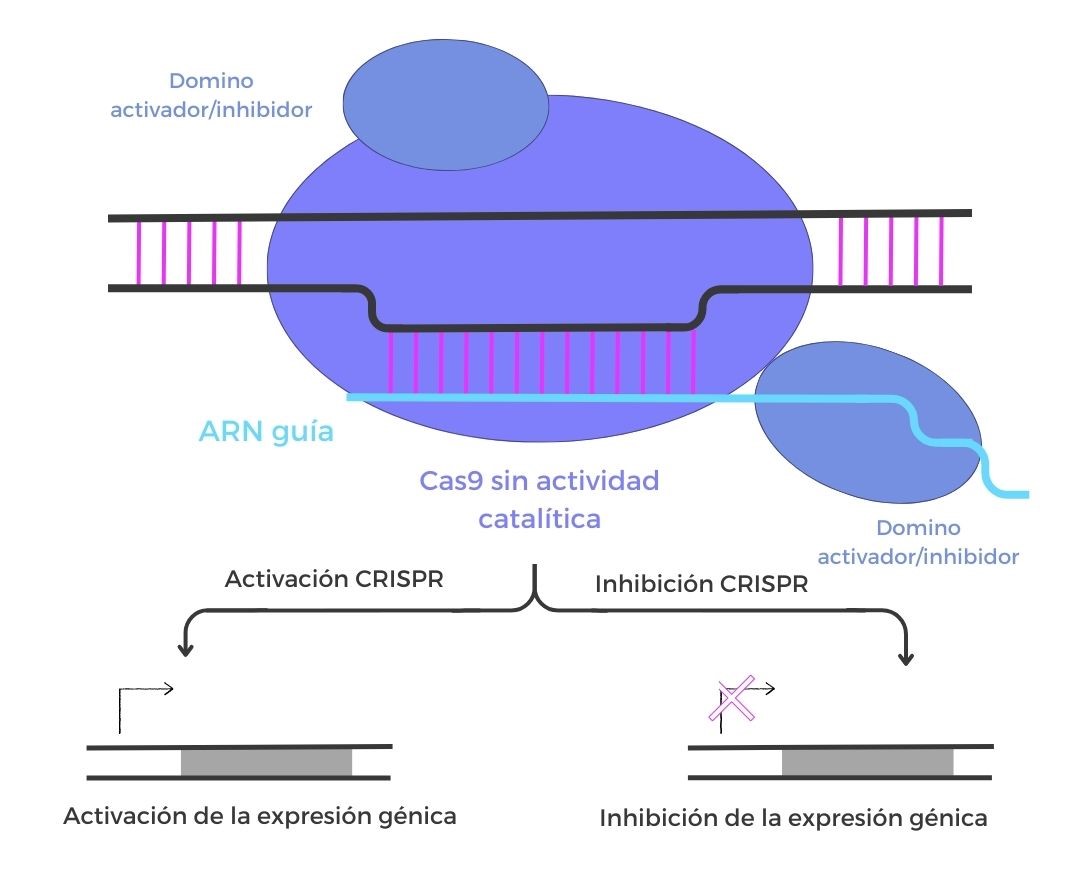
Edición del epigenoma
La tecnología CRISPR no solamente se ha aplicado a la edición genómica, sino que ha dado un paso más hacia la edición del epigenoma. Estas herramientas de edición epigenética están basadas en la acción de una proteína Cas9 sin actividad catalítica, a la que se le añade un dominio activador o inhibidor. La utilización de este tipo de tecnología CRISPR puede servir para activar o inactivar la expresión de genes específicos.
Aplicaciones en Salud
Las herramientas CRISPR-Cas se han convertido en una tecnología muy prometedora para la edición genética capaz de editar, corregir y alterar el genoma y el epigenoma de cualquier célula de una manera fácil, rápida, barata y altamente precisa. En la actualidad diferentes laboratorios trabajan para perfeccionar las herramientas CRISPR y adaptarlas a su utilización en la terapia e investigación de enfermedades.
Por ejemplo, recientemente un equipo de investigadores del IIS La Fe de Valencia y el CIBERER en colaboración con el Instituto de Biotecnología y Biomedicina de la Universitat de València e IIS INCLIVA han utilizado la tecnología de edición génica CRISPR-Cas9 para corregir la mutación causante de la enfermedad en un modelo celular.
Y bien, hasta aquí el post de hoy. Si os interesa la edición genómica y queréis profundizar más en su utilización en salud, te recomendamos el programa “Introducción a la Terapia Génica y Edición del Genoma”. Y si quieres algo más aplicado, entonces te interesa nuestro curso “Edición del Genoma mediante CRISPR y células madre pluripotentes inducidas en la investigación de enfermedades genéticas”. ¡Nos leemos en el siguiente post!
Artículos de interés:
Musunuru K. CRISPR and cardiovascular diseases. Cardiovasc Res. 2023 Mar 17;119(1):79-93. doi: 10.1093/cvr/cvac048
CRISPR en la naturaleza. Innovative Genomics Institute. https://innovativegenomics.org/es/crisprpedia/crujiente-en-la-naturaleza/