Blog
Diagnóstico Genético Preimplantacional: ¿Qué es? ¿Para qué sirve?
- noviembre 29, 2017
Irene Sebastián
Martina y Daniel son padres de un hijo que tiene Fibrosis quística, una enfermedad hereditaria autosómica recesiva. Ellos no padecen esta enfermedad, por lo que ambos son portadores de alelos responsables de la Fibrosis quística. Martina y Daniel desean tener otro hijo, pero están preocupados porque no quieren que esté afectado por dicha enfermedad. Para ello, eligen someterse a un Diagnóstico Genético Preimplantacional.
El Diagnóstico Genético Preimplantacional, mejor conocido como PGD por sus siglas en inglés, es una prueba que se emplea para detectar si hay algún trastorno genético o cromosómico en los embriones obtenidos mediante una fecundación in vitro.
¿A quién va dirigido?
Existen varias situaciones en las que se puede plantear el uso del PGD. Una de ellas es aquella en la que los padres ya saben que son portadores y hay antecedentes familiares de alguna enfermedad genética y no quieren que sus hijos la padezcan, como es el caso de Martina y Daniel. Otra de ellas se da cuando los padres no saben si son portadores o no. En este caso, se les hace un cribado para una selección de enfermedades mendelianas recesivas. Por último, también se puede emplear cuando la madre es de una edad materna avanzada o cuando tiene un historial de abortos reiterado.
¿Cómo es el procedimiento?
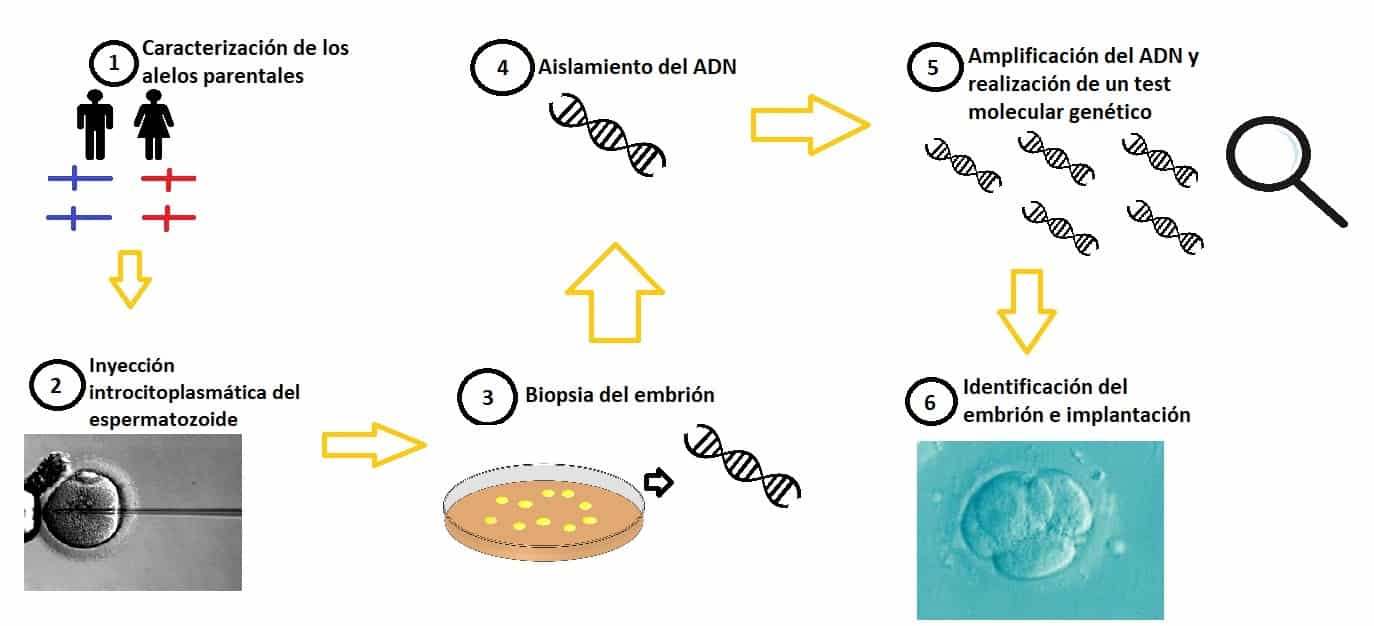
Volvamos al caso de la pareja Martina y Daniel. Como se ha mencionado anteriormente, la pareja está sana, pero son portadores de la enfermedad. Se someten a una serie de pruebas genéticas con el fin estudiar el gen CFTR implicado en la Fibrosis quística. El análisis de este gen revela que la combinación de dos alelos con el gen mutado podría manifestar la enfermedad. Además, las secuencias de ADN cercanas a este alelo de interés serán tomadas como marcadores asociados a la presencia o ausencia de mutación.
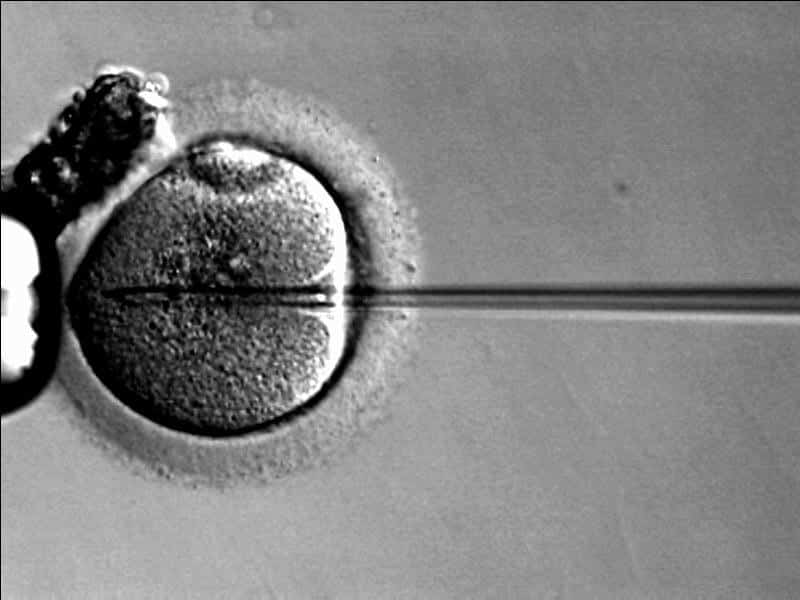
Una vez realizado todo este procedimiento, el siguiente paso es una fecundación in vitro. Para ello, se recuperan los ovocitos de Martina mediante una hiperestimulación ovárica y se fecundan con los espermatozoides de Daniel a través de una inyección intracitoplasmática. Los zigotos obtenidos son cultivados en el laboratorio y, 5-6 días después de la fecundación, se extraen unas pocas células (5-8 células) para realizarles la biopsia.
De estas células se aísla una pequeña cantidad de ADN que será analizado para detectar posibles anormalidades en el embrión.
Fecundación in vitro. Imagen de Wikimedia Commons
¿Cómo se analiza?
El ADN obtenido del embrión puede ser amplificado mediante la reacción en cadena de la polimerasa (PCR) o mediante una amplificación de todo el genoma (WGA).
En la técnica de la PCR selecciona el fragmento específico de ADN donde se encuentra el gen de interés y se hacen muchas copias de éste para detectar mutaciones concretas. Recordemos que en el caso de Martina y Daniel sería el gen CFTR causante de la Fibrosis quística.
Por otro lado, en la técnica de WGA lo que se pretende es amplificar todo el genoma con el objetivo de identificar posibles aneuploidías (número anormal de cromosomas). Una de las ventajas de esta técnica es que gracias a los últimos avances en secuenciación masiva, permite secuenciar varios embriones a la vez, pero suele tener una tasa de error mayor que la PCR.
Una vez realizada la amplificación, se estima el número de mutaciones de cada embrión y se identifican por el número de mutaciones que contienen (0, 1 o 2 mutaciones). Finalmente, se transferirá el embrión que no contenga mutaciones. En el caso de que no haya embriones sin mutaciones, se les planteará la posibilidad a los padres de transferir un embrión que tenga una o dos mutaciones (sólo en el caso de que sean autosómicas recesivas) sabiendo que el feto será portador. Una vez informados los padres, valorarán la posibilidad de transferirlo o no. Los embriones restantes se conservarán mediante una técnica de congelación rápida por si hiciesen falta después.
El PGD
El primer PGD se realizó en los años 90, pero sólo se empleó para identificar enfermedades ligadas al cromosoma X. Sin embargo, en las últimas décadas los avances como la amplificación del ADN y mejoras en las técnicas de cultivo de embriones y en los test moleculares genéticos han permitido realizar diagnósticos más precisos. En la actualidad, el PGD es empleado para seleccionar embriones libres de enfermedades autosómicas recesivas como la Fibrosis quística, autosómicas dominantes como la enfermedad de Huntington y las enfermedades ligadas al cromosoma X como la Distrofia muscular de Duchenne.
A pesar de su utilidad y elevada exactitud, esta técnica no tiene una precisión del 100%. Existe una pequeña probabilidad de que haya un diagnóstico incorrecto, ya sea por un error humano, un error en la amplificación o porque se hayan contaminado las muestras.
Es importante que se les informe siempre a los futuros padres de cuáles son los riesgos, beneficios y limitaciones del PGD y se les aconseje sobre qué hacer.
El PGD es un método muy útil para ayudar a aquellos padres portadores que no quieren tener un hijo que padezca una enfermedad grave. Con ella lo que se pretende es reducir el riesgo de tener un niño afectado. Actualmente, el empleo de esta técnica tiene un alto coste, por eso su uso no es muy habitual. Se espera que con el avance de la tecnología se consiga reducir el precio y esté al alcance de un mayor número de personas.
Artículo de referencia
Dolan, S.M., Goldwaser, T.M., Jindal, S.K. (2017). Preimplantation Genetic Diagnosis for Mendelian Conditions.
Categorías
Categorías
Cursos relacionados

Contacto
¿Quieres publicar con nosotros? ¿Tienes dudas?
Contacta con nosotros de la manera que prefieras y te responderemos a la mayor brevedad.