Al igual que Aquiles, bendecido con el don de la invulnerabilidad en todo su cuerpo excepto en uno de sus talones, todos y cada uno de nosotros tenemos un punto débil. Algunos no soportamos el calor y otros se desmayan al ver algo de sangre. Bien, pues lo mismo les sucede a las células cancerosas. Como son células “mutadas”, diferentes al resto de las células de nuestro cuerpo, es posible diseñar estrategias que solo puedan causar la muerte de estas células, sin eliminar las células no cancerosas. Exacto. Hablo de un “talón de Aquiles” que únicamente presentan las células tumorales: la letalidad sintética.
Letalidad sintética: qué es y cómo funciona
Aunque el concepto de “letalidad sintética” es un concepto bastante reciente en oncología, no es nuevo en genética. La letalidad sintética, en genética, hace referencia a un tipo de interacción entre genes. Se denomina “letal sintético” a cualquier organismo con dos mutaciones que juntas son letales, pero no de forma individual. De este modo, un individuo con mutaciones en los genes “A” o “B” no moriría, mientras que el destino sería fatal para uno con mutaciones en ambos.
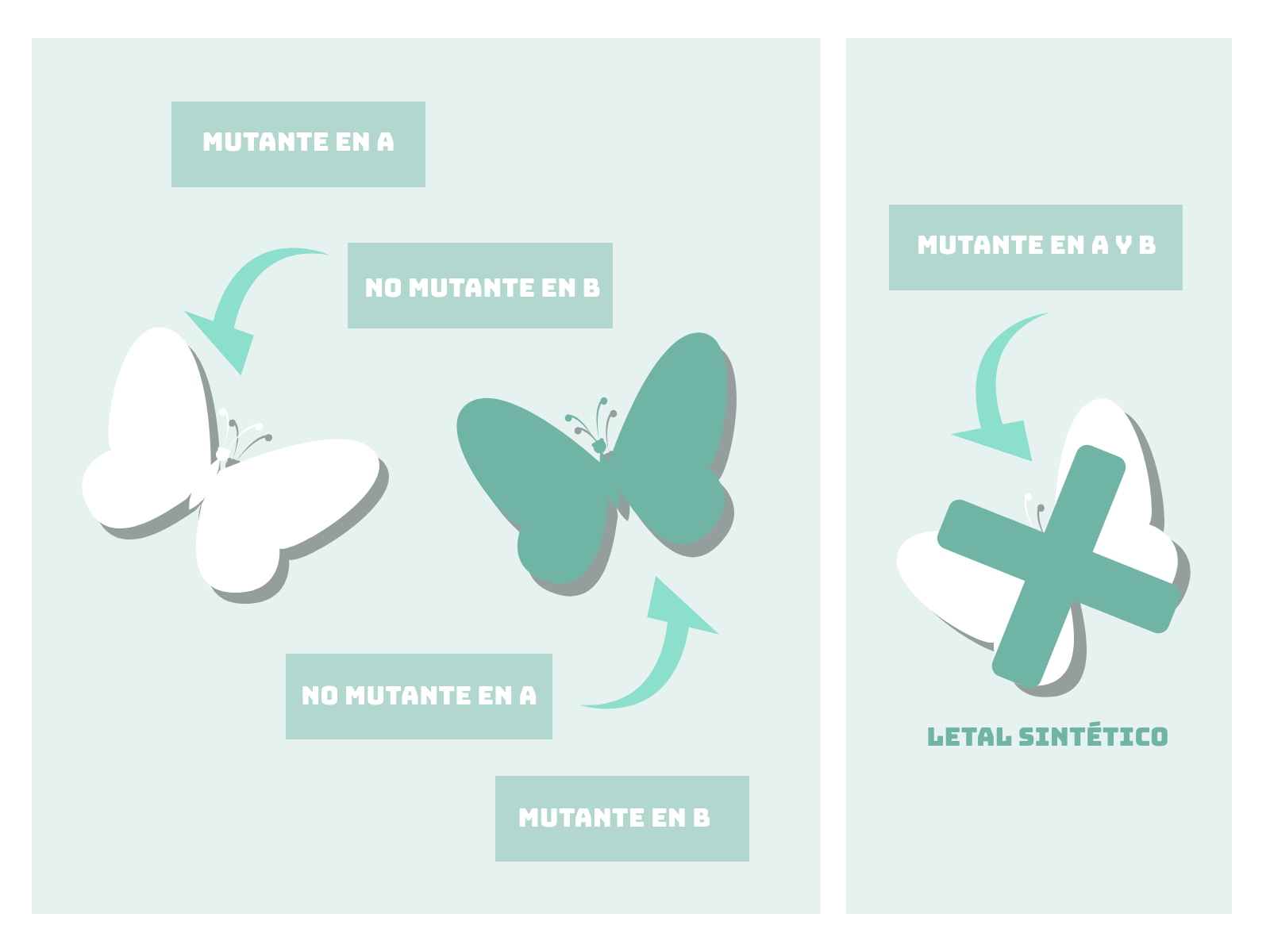
La clave de la utilización de esta interacción genética como técnica en oncología es que las células tumorales presentan mutaciones que no presentan las células sanas. Es el caso de los genes BRCA1 y BRCA2 que, en muchas ocasiones, se presentan mutados en tumores de mama y ovario. Mutaciones en estos genes hacen que las células cancerosas presenten deficiencias en los mecanismos de reparación del ADN.

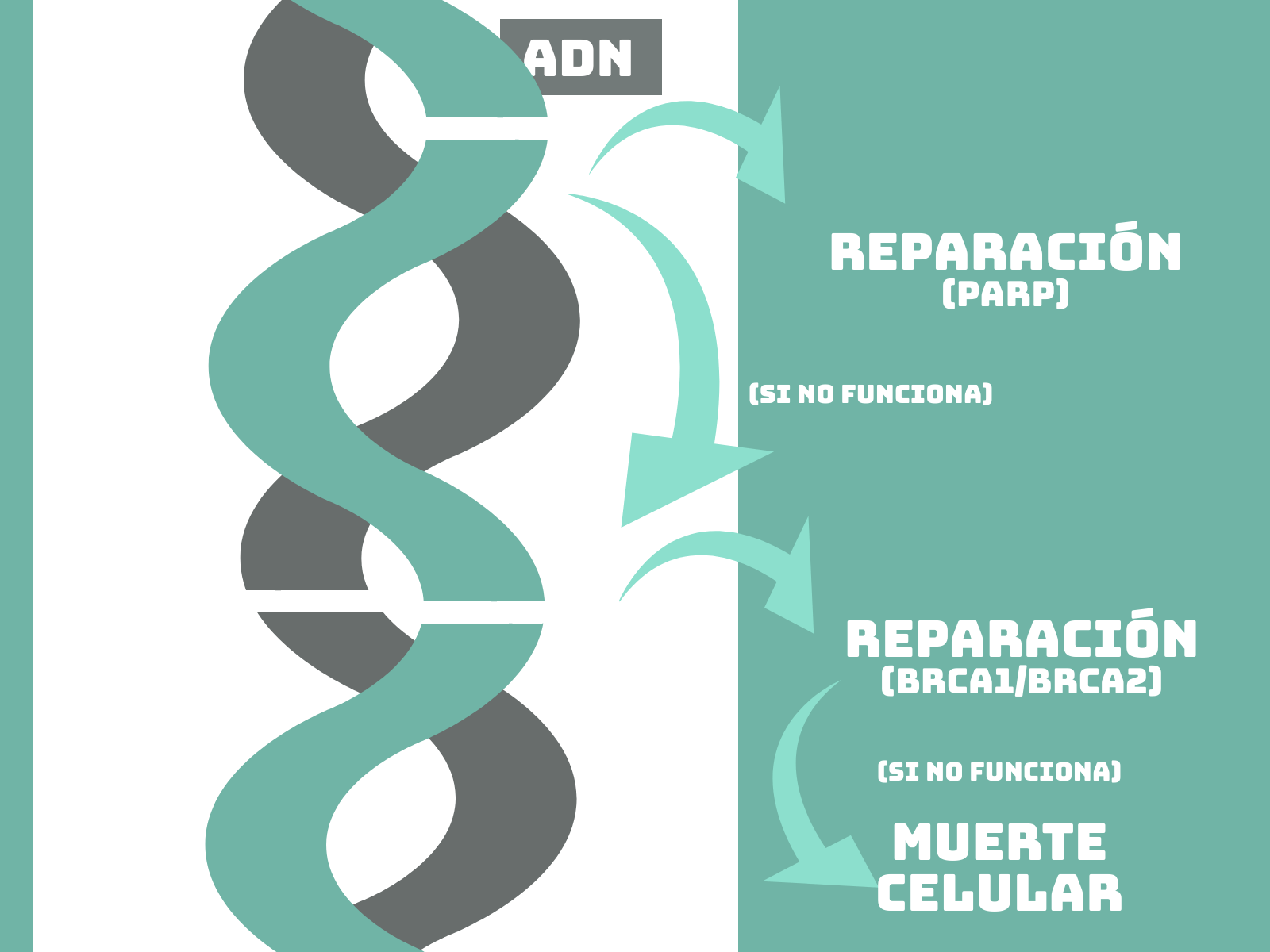
Como podréis imaginar, nuestras células no son tan simples y tienen diferentes mecanismos de reparación que actúan en conjunto para evitar la acumulación de daños en el ADN. Normalmente, cuando una cadena de ADN se rompe, existe un mecanismo de reparación conocido como PAR-ilacion que consigue reestablecer la cadena de ADN. Si este mecanismo no funciona, la rotura en la primera cadena de ADN puede provocar una segunda rotura en la cadena complementaria. En ese caso, las células utilizan un complejo enzimático que consigue repararlo mediante recombinación homóloga. Las enzimas BRCA1 y BRCA2 forman parte de este complejo enzimático.
¿Cómo utilizar la letalidad sintética para el tratamiento del cáncer?
Os imaginareis por donde van los tiros. Si inhibimos mediante fármacos la actividad PARP, que lleva a cabo la PAR-ilación, generamos deficiencias en la reparación de todas las células del organismo. Al no haber actividad PARP, las células que sufran daños en su ADN deberán recurrir a otros mecanismos de reparación, como la actividad de BRCA1 y BRCA2, para reparar su ADN. De este modo, estaríamos generando letalidad sintética en las células tumorales, mientras que las células normales podrían seguir reparando su ADN, ya que no tienen la actividad BRCA1 ni BRCA2 alterada.
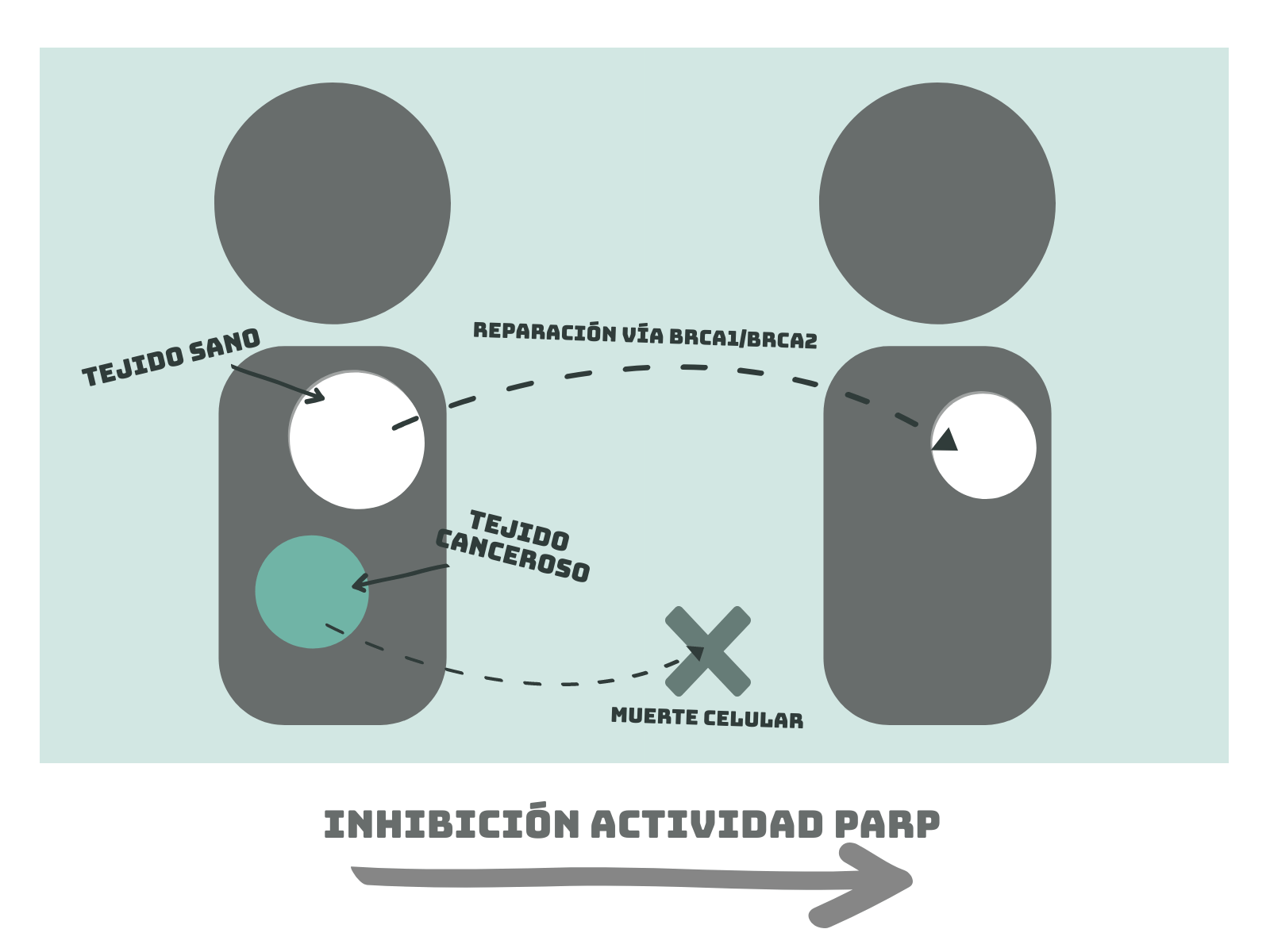
El problema de esta técnica es que, del mismo modo que hay millones de personas distintas con diferentes “puntos débiles”, también hay millones de cánceres distintos con mutaciones totalmente diferentes. Por este motivo se siguen investigando este tipo de interacciones entre genes que producen letalidad sintética. Por ejemplo los genes RAD17 o XRCC3, ambos genes supresores de tumores. En el primer caso, se conocen diferentes fármacos inhibidores como el irinotecan, que, en tumores con mutaciones que afectan a la función de RAD17, causa la muerte celular.
¿Y bien? Ya conocéis cómo funciona la letalidad sintética, una de las terapias contra el cáncer más prometedoras que se conocen actualmente. Si te interesa el tema, en Genética Médica News tenemos algunos artículos sobre ello. ¡Nos leemos en el próximo post!