Una vez que sabemos las condiciones cósmicas y planetarias para permitir la existencia de la vida es hora de preguntarnos: ¿qué es la vida? No existe una definición de vida, sino cientos. Muchas de ellas satisfacen algunos aspectos, pero ninguna engloba todos sus atributos. A la hora de definir qué es la vida hay que plantearse si la definición debe realizarse para definir únicamente la vida terrestre, o si por el contrario deberíamos definirla para cualquier forma de vida, terrestre o alienígena. En este sentido la definición de vida más aceptada por su simplicidad y precisión es la acuñada por Jerry Joyce en 1994 y que el Instituto de Astrobiología de la NASA ha aceptado como oficial: “La vida es un sistema químico autosostenible capaz de experimentar evolución«.
Si nos queremos ceñir a la vida en la Tierra, quizás lo más adecuado sería definirla mediante su composición básica: genoma, metabolismo y compartimentación. El genoma tiene como función contener toda la información que vaya a ser necesaria a lo largo de la vida del ser vivo, además debe de estar sujeto a cambios en la información que permitan la evolución. El metabolismo puede definirse como el intercambio de materia y energía con el medio, y consiste en todas las reacciones químicas (bioquímicas) necesarias para la autosostenibilidad del ser vivo. Por último y no menos importante, la compartimentación mediante envoltura permite la generación de un microcosmos químico en el interior del compartimento, alejado del equilibrio químico y que permite el metabolismo.
Lo que caracteriza a la química de la vida en la Tierra es que se basa, como hemos dicho, en carbono y agua. La química del carbono es la química orgánica. El carbono es un elemento de la tabla periódica, como cualquier otro, que tiene una fascinante cualidad que lo diferencia del resto: forma enlaces covalentes (el tipo de enlaces que unen los átomos entre sí para formar las moléculas complejas) consigo mismo (otros átomos de carbono, generando moléculas de gran tamaño) y con otros elementos de manera estable (generando los grupos funcionales). Los grupos funcionales son imprescindibles para que haya reactividad, únicamente con carbono no podría haber vida.
Ningún otro átomo es capaz de establecer enlaces de esta manera. Un candidato aclamado por la ciencia ficción ha sido el silicio, sin embargo, la complejidad de las moléculas basadas en silicio es demasiado baja para sustentar una química compleja. El silicio puede formar enlaces únicamente consigo mismo y con oxígeno, y con una complejidad mucho menor que el carbono. Las razones por las que el carbono tiene estas propiedades y el resto de los elementos no, se debe a su distribución electrónica, cuya explicación hunde sus raíces en la mecánica cuántica, por lo que no nos adentraremos en los motivos. Por ello, la comunidad científica está de acuerdo en que, de haber una vida extraterrestre, esté probablemente basada en carbono (aunque existen científicos más optimistas).
El otro gran protagonista, el agua, es imprescindible porque la gran mayoría de reacciones bioquímicas ocurren en su seno. Además de permitir un gran número de reacciones (más que cualquier otro disolvente), participa activamente en muchas de ellas. De hecho, muchas moléculas orgánicas necesitan una capa de agua a su alrededor para ser estables. Por otro lado, juega un papel muy importante en generar la disposición en el espacio de las moléculas que generan la compartimentación, como veremos más adelante. Además, se trata de una molécula muy abundante en el Universo (Liu et al., 2016).
LA BIOQUÍMICA TERRESTRE
La bioquímica de la vida puede resumirse rápidamente. Los genomas están compuestos de ácidos nucleicos (ADN en la mayoría de los seres vivos o ARN en algunos virus), el metabolismo es llevado a cabo principalmente por las proteínas, y la compartimentación consiste en membranas compuestas de lípidos (grasas).
Tanto el ADN como el ARN son polímeros, es decir, cadenas de monómeros unidos unos a otros de forma lineal. Los monómeros son conocidos como nucleótidos (para el ADN) o ribonucleótidos (para el ARN). Tanto los nucleótidos como los ribonucleótidos están compuestos de tres partes: un ácido fosfórico, un azúcar (una ribosa) y una base nitrogenada. Tanto los nucleótidos como los ribonucleótidos comparten el mismo ácido fosfórico. El azúcar es ligeramente distinto entre unos y otros: el ADN tiene un átomo de oxígeno menos en su azúcar que el ARN (de ahí lo de disoxi-rribonucleico).
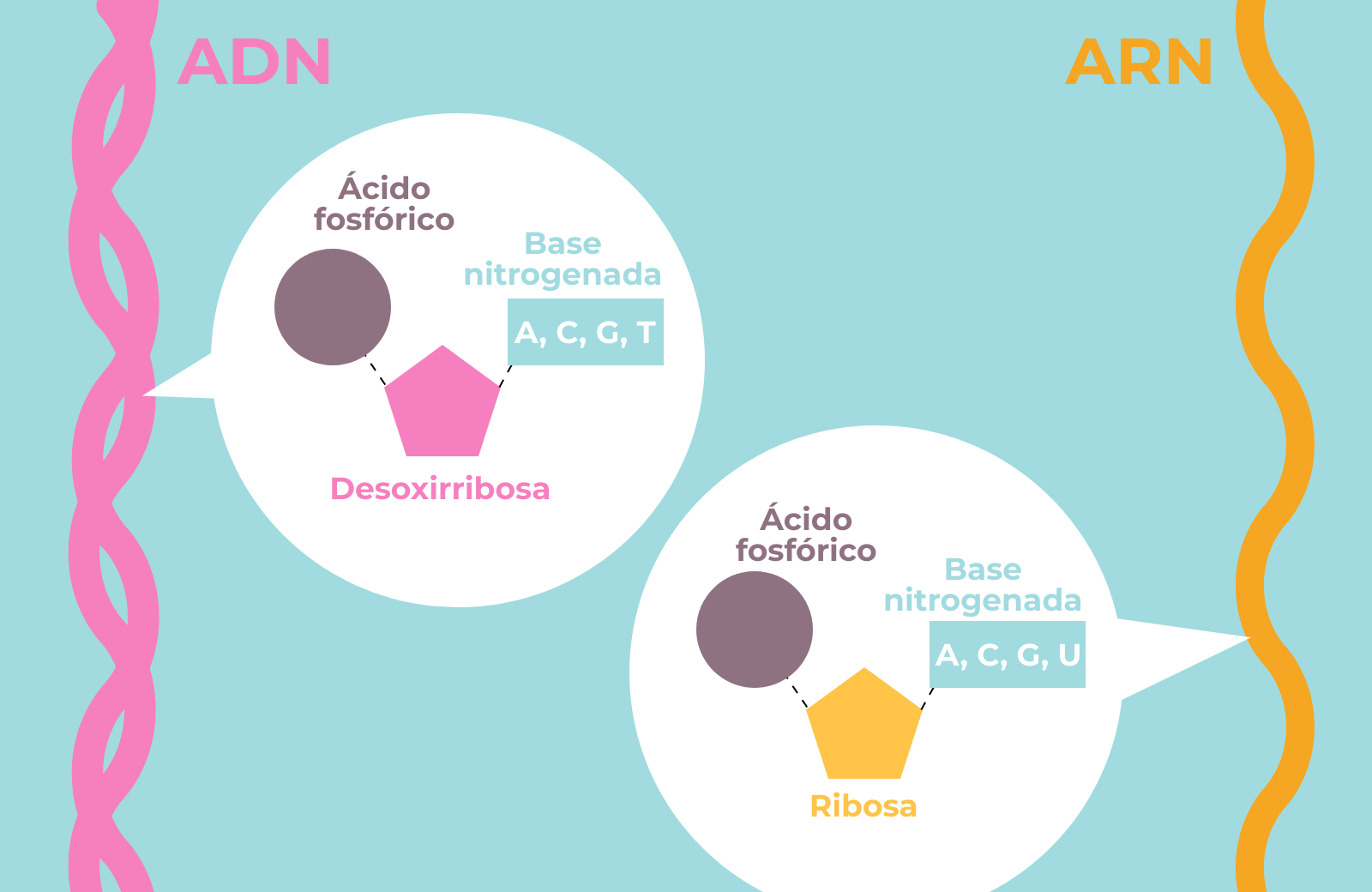
En cuanto a las bases nitrogenadas, el ADN consta de cuatro tipos: adenina (A), timina (T), citosina (C) y guanina (G). El ARN comparte la A, la C y la G, pero sustituye la T por el uracilo (U). El ADN está en forma de doble cadena, y es tremendamente estable, mientras que el ARN existe en forma de una única cadena, y se degrada con mayor facilidad. En la vida en la Tierra, el ADN contiene la información, que se transcribe a ARN, y este se traduce a proteínas. La transcripción la llevan a cabo proteínas, y la traducción un orgánulo llamado ribosoma que es una mezcla de proteínas y un tipo especial de ARN (ARN ribosómico).
Las proteínas también son polímeros, cuyos monómeros son los aminoácidos. Las proteínas desempeñan todas y cada una de las funciones que la célula necesita, son la mano de obra. En la vida terrestre existen 20 tipos de aminoácidos, con propiedades físico-químicas muy distintas: con carga eléctrica, sin ella, grandes, pequeños, hidrofílicos (interaccionan con el agua), hidrofóbicos (no interaccionan con el agua), ácidos (libera protones), básicos (capta protones) (Dwyer, 2008). Las proteínas son cadenas muy largas, en las que los eslabones son los aminoácidos, que se pliegan tridimensionalmente de una manera muy específica. En la función de las proteínas es tan importante la secuencia de aminoácidos como su plegamiento (Gosavi, 2013).
Por último, las membranas biológicas están constituidas por fosfolípidos. Podemos imaginar un fosfolípido como un “chupachup”, en el que el palo es una cadena de carbonos hidrofóbica (repele el agua) y la bola de caramelo es un fosfato (interacciona con el agua). Este tipo de molécula, que tienen una parte hidrofílica o polar y una parte hidrofóbica o apolar, se conoce como anfipática. Las membranas biológicas forman bicapas. Las partes hidrofóbicas de los fosfolípidos interaccionan una con otra, orientadas en la misma dirección, pero en sentido contrario, de forma que los extremos de los “palos del chupachup” están en contacto. Se genera una bicapa que delimita un entorno acuoso en el interior del compartimento y el medio externo también acuoso. Este tipo de estructuras compartimentales se forman principalmente en presencia de agua.
EL PROBLEMA DEL HUEVO Y LA GALLINA
Sabemos cuáles son los polímeros y los monómeros en los que se sustenta la vida, pero para atacar el problema del origen de la vida en la Tierra debemos contestar dos preguntas. ¿Las biomoléculas que sustentan hoy la vida son las mismas que la originaron? Y de ser así, ¿cómo se formaron?
La química prebiótica es el campo de estudio que intenta explicar cómo pudieron surgir los primeros organismos vivos a partir de moléculas inertes (Cleaves, 2013). La síntesis de ARN (polimerización de ribonucleótidos) es mucho más simple y se da de manera más espontánea que la de ADN. Este y otros motivos indican que los primeros genomas eran basados en ARN, y no en ADN.
Además, las proteínas requieren de un código genético tremendamente complejo que no pudo surgir de manera espontánea en los primeros organismos, ya que involucra una maquinaria molecular determinada que no pudo haberse originado de manera espontánea (Lazcano and Miller, 1996; Higgs and Lehman, 2015).
Esto nos recuerda al problema del huevo y la gallina: si es el ARN el que tiene la información para codificar las proteínas, y son las proteínas las que replican el ARN y las que llevan a cabo el paso de ARN a proteína, ¿qué existió primero? Este enigma se empezó a resolver cuando se descubrió que los ARN tenían actividad catalítica (Moelling and Broecker, 2021).
La catálisis es la piedra angular de la vida. Existen dos ramas de la química que predicen si una reacción se producirá y cuándo lo hará. La termodinámica determina el grado de espontaneidad de la reacción. Simplificando, una reacción es posible si es termodinámicamente espontánea, y es imposible si no lo es (realmente hace referencia a la probabilidad de que se dé la reacción).
La cinética hace referencia a cuánto tiempo tenemos que esperar para que se dé la reacción. Hace falta que se acumule una cierta energía hasta que se llegue a la energía de activación de la reacción, y sólo entonces ésta ocurre. De modo que una reacción puede ser posible a nivel termodinámico, pero la cinética puede establecer que tardará miles de millones de años en alcanzarse la energía de activación, por lo que, a efectos prácticos, la reacción no ocurre.
Un catalizador lo que hace es disminuir la energía de activación, de modo que la reacción se da de manera inmediata (no afecta a la termodinámica, sólo a la cinética) (Alberty, 2006). Los principales catalizadores en la vida son las enzimas, que no son más que proteínas con actividad catalítica. Pero, una enzima no puede sintetizarse sin una actividad catalítica, de nuevo el problema del huevo y la gallina.
Los químicos Thomas R. Cech, en 1982, y Sidney Altman, en 1983, mostraron de manera independiente que algunos ARN tienen actividad catalítica. Recibieron el premio Nobel de química en 1989. Denominaron a estos ARNs ribozimas. Las enzimas proteicas suelen usar coenzimas, que son moléculas no proteicas, para ayudar a catalizar la reacción.
Muchas coenzimas son derivados de ribonucleótidos, lo que algunos consideran un remanente de estos orígenes de la vida basada en ribozimas (Jadhav and Yarus, 2002). Además, el paso clave de síntesis de proteínas a partir de ARN lo hace el ribosoma, un orgánulo constituido por proteínas y ARN ribosómico, como hemos comentado antes. Este conjunto de hipótesis que ponen al ARN como genoma a la vez que como maquinaria enzimática se le conoce como Mundo del ARN, y es hoy en día ampliamente aceptada, resolviendo el problema del huevo y la gallina: ambos serían el ARN (Lazcano and Miller, 1996; Higgs and Lehman, 2015).
Sin embargo, que el ARN pueda desempeñar actividades catalíticas no implica que sea capaz de replicar su propio genoma. Ese es el gran problema de la teoría del Mundo del ARN. Existen experimentos que demuestran que ciertos ARNs son capaces de catalizar reacciones de polimerización de ARN, pero lo hacen a una velocidad demasiado baja y en unas condiciones tan especiales que induce a pensar que aún faltan muchas piezas del rompecabezas. Además, una cosa es polimerizar ARN de forma aleatoria, lo que sí se ha conseguido, y otra muy distinta es replicarlo (a partir de una secuencia molde sintetizar una complementaria) lo que de momento no se ha logrado. Se cree que el ARN no funcionaría sólo, sino con ayuda de cofactores (átomos metálicos que hoy en día siguen siendo necesarios para muchas reacciones), coenzimas (como las vitaminas) y péptidos (pequeñas proteínas sintetizadas de manera espontánea y secuencia aleatoria)(Higgs and Lehman, 2015).
Por tanto, podemos atisbar qué estrategias pudieron haber seguido las primeras formas de vida en cuanto al problema del genoma y el metabolismo. Pero nos queda el problema de la compartimentación. La vida en la Tierra como hemos dicho basa sus membranas en fosfolípidos, pero éstas son moléculas muy complejas de sintetizar, por lo que se cree que las primeras envolturas no serían a base de fosfolípidos. Un buen candidato para primer constituyente de las membranas son los ácidos grasos. Esto son moléculas más simples, posibles de sintetizarse espontáneamente en la Tierra primigenia y también anfipáticas (Deamer et al., 2002; n, Eunsung Mouradian, 2008; Deamer, 2017).
Referencias
Aguilera, JA. El Origen de La Vida. RBA Editorial. 2019. ISBN: 9788491873341.
Alberty, R. A. (2006) ‘Relations between biochemical thermodynamics and biochemical kinetics’, Biophysical Chemistry, 124(1), pp. 11–17. doi: 10.1016/j.bpc.2006.05.024.
Andrulis, E. D. (2011a) ‘Theory of the origin, evolution, and nature of life’, Life. Life (Basel), 2(1), pp. 1–105. doi: 10.3390/life2010001.
Arney, G., et al. (2018) ‘Venus as an analog for hot earths’, arXiv. doi: 10.2458/azu_uapress_9780816540068-ch014.
Ballen, C. J. and Greene, H. W. (2017) ‘Walking and talking the tree of life: Why and how to teach about biodiversity’, PLoS Biology, 15(3), pp. 1–11. doi: 10.1371/journal.pbio.2001630.
Bang, B. and Bang, B. (2008) ‘Wilkinson Microwave Anisotropy Probe Cosmology: The Study of the Universe’, pp. 10–19.
Bell, E. A. et al. (2015) ‘Potentially biogenic carbon preserved in a 4.1 billion-year-old zircon’, Proceedings of the National Academy of Sciences of the United States of America, 112(47), pp. 14518–14521. doi: 10.1073/pnas.1517557112.
Betts, H. C. et al. (2019) ‘Europe PMC Funders Group Integrated genomic and fossil evidence illuminates life ’ s early evolution and eukaryote origins’, 2018(10), pp. 1556–1562. doi: 10.1038/s41559-018-0644-x.Integrated.
Briones, C. ¿Estamos solos? En busca de otras vidas en el cosmos. CRITICA. 2020. ISBN: 9788491992219.
Callier, V. (2019) ‘Gene transfers from bacteria and viruses may be shaping complex organisms’, Proceedings of the National Academy of Sciences of the United States of America, 116(28), pp. 13714–13716. doi: 10.1073/pnas.1909030116.
CAVALIER-SMITH, T. (1998) ‘A revised six-kingdom system of life’, Biological Reviews of the Cambridge Philosophical Society, 73(3), pp. 203–266. doi: 10.1017/s0006323198005167.
Ciccarelli, F. D. et al. (2006) ‘of a Highly Resolved Tree of Life’, Science, 311(March), pp. 1283–1287. Available at: http://www.ncbi.nlm.nih.gov/pubmed/16513982.
Cleaves, H. J. et al. (2012) ‘Mineral–organic interfacial processes: Potential roles in the origins of life’, Chemical Society Reviews, 41(16), pp. 5502–5525. doi: 10.1039/c2cs35112a.
Cleaves, H. J. (2013) ‘Prebiotic chemistry: Geochemical context and reaction screening’, Life, 3(2), pp. 331–345. doi: 10.3390/life3020331.
Darwin, CR. El Origen De Las Especies Por Medio De La Selección Natural. 2009. Alianza editorial. ISBN: 978-84-206-6867-3 (Obra original publicada en: 1858).
Deamer, D. et al. (2002) ‘ASTROBIOLOGY Volume 2, Number 4, 2002 © Mary Ann Liebert, Inc.’, Astrobiology, 2(4), pp. 371–381.
Deamer, D. (2017) ‘The role of lipid membranes in life’s origin’, Life, 7(1). doi: 10.3390/life7010005.
Deamer, D. and Weber, A. L. (2010) ‘Bioenergetics and Life ’ s Origins’, pp. 1–16.
Dodd, M. S. et al. (2017) ‘Evidence for early life in Earth’s oldest hydrothermal vent precipitates’, Nature. Nature Publishing Group, 543(7643), pp. 60–64. doi: 10.1038/nature21377.
Duda, J. P. et al. (2016) ‘A rare glimpse of paleoarchean life: Geobiology of an exceptionally preserved microbial mat facies from the 3.4 ga strelley pool formation, Western Australia’, PLoS ONE, 11(1), pp. 1–18. doi: 10.1371/journal.pone.0147629.
Dwyer, D. S. (2008) ‘Amino Acids: Chemical Properties’, Wiley Encyclopedia of Chemical Biology, (July). doi: 10.1002/9780470048672.wecb007.
Eme, L. et al. (2017) ‘Archaea and the origin of eukaryotes’, Nature Reviews Microbiology, 15(12), pp. 711–723. doi: 10.1038/nrmicro.2017.133.
Fournier, G. P., et al. (2015) ‘Ancient horizontal gene transfer and the last common ancestors Phylogenetics and phylogeography’, BMC Evolutionary Biology. ???, 15(1), pp. 1–18. doi: 10.1186/s12862-015-0350-0.
García-Ruiz, J. M., et al. (2020a) ‘Mineral self-organization on a lifeless planet’, Physics of Life Reviews. Elsevier B.V., 34–35, pp. 62–82. doi: 10.1016/j.plrev.2020.01.001.
Di Giulio, M. (2007) ‘The universal ancestor and the ancestors of Archaea and Bacteria were anaerobes whereas the ancestor of the Eukarya domain was an aerobe’, Journal of Evolutionary Biology, 20(2), pp. 543–548. doi: 10.1111/j.1420-9101.2006.01259.x.
Gosavi, S. (2013) ‘Understanding the Folding-Function Tradeoff in Proteins’, PLoS ONE, 8(4). doi: 10.1371/journal.pone.0061222.
Gowanlock, M. G., Patton, D. R. and McConnell, S. M. (2011) ‘A model of habitability within the Milky Way galaxy’, Astrobiology, 11(9), pp. 855–873. doi: 10.1089/ast.2010.0555.
Halliday, A. N. and Able, T. (2006) ‘The Origin of the Earth What ’ s New ? FORMATION’, Earth, pp. 205–210.
Hassenkam, T. et al. (2017) ‘Elements of Eoarchean life trapped in mineral inclusions’, Nature. Nature Publishing Group, 548(7665), pp. 78–81. doi: 10.1038/nature23261.
Hazen, R. M. and Sverjensky, D. A. (2010) ‘Mineral surfaces, geochemical complexities, and the origins of life.’, Cold Spring Harbor perspectives in biology, 2(5), pp. 1–21. doi: 10.1101/cshperspect.a002162.
Higgs, P. G. and Lehman, N. (2015) ‘The RNA World: Molecular cooperation at the origins of life’, Nature Reviews Genetics. Nature Publishing Group, 16(1), pp. 7–17. doi: 10.1038/nrg3841.
Ikehara, K. (2016) ‘Evolutionary steps in the emergence of life deduced from the bottom-up approach and GADV hypothesis (Top-down approach)’, Life, 6(1), pp. 1–15. doi: 10.3390/life6010006.
Jadhav, V. R. and Yarus, M. (2002) ‘Coenzymes as coribozymes’, Biochimie, 84(9), pp. 877–888. doi: 10.1016/S0300-9084(02)01404-9.
Johnson, J. A., et al. (2020) ‘The origin of the elements: A century of progress’, Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences, 378(2180). doi: 10.1098/rsta.2019.0301rsta20190301.
Keeling, P. J. and Palmer, J. D. (2008) ‘Horizontal gene transfer in eukaryotic evolution’, Nature Reviews Genetics, 9(8), pp. 605–618. doi: 10.1038/nrg2386.
Kellermeier, M. et al. (2013) Experimental techniques for the growth and characterization of silica biomorphs and silica gardens, Methods in Enzymology. doi: 10.1016/B978-0-12-416617-2.00011-4.
Kellermeier, M., Cölfen, H. and García-Ruiz, J. M. (2012) ‘Silica biomorphs: Complex biomimetic hybrid materials from “sand and chalk”’, European Journal of Inorganic Chemistry, (32), pp. 5123–5144. doi: 10.1002/ejic.201201029.
Khurana, K. K., et al. (2002) ‘Using Surface Observatories’, Astrobiology, 2(1), pp. 93–103.
Kitadai, N. and Maruyama, S. (2018) ‘Origins of building blocks of life: A review’, Geoscience Frontiers. Elsevier, 9(4), pp. 1117–1153. doi: 10.1016/j.gsf.2017.07.007.
Kotopoulou, E. et al. (2021) ‘Nanoscale Anatomy of Iron-Silica Self-Organized Membranes: Implications for Prebiotic Chemistry’, Angewandte Chemie – International Edition, 60(3), pp. 1396–1402. doi: 10.1002/anie.202012059.
Kumar, S. (2005) ‘Molecular clocks: Four decades of evolution’, Nature Reviews Genetics, 6(8), pp. 654–662. doi: 10.1038/nrg1659.
Lambert, J. F. (2008) ‘Adsorption and polymerization of amino acids on mineral surfaces: A review’, Origins of Life and Evolution of Biospheres, 38(3), pp. 211–242. doi: 10.1007/s11084-008-9128-3.
Lauro, S. E. et al. (2021) ‘Multiple subglacial water bodies below the south pole of Mars unveiled by new MARSIS data’, Nature Astronomy. Springer US, 5(1), pp. 63–70. doi: 10.1038/s41550-020-1200-6.
Lazcano, A. and Miller, S. L. (1996) ‘The origin and early evolution of life: Prebiotic chemistry, the pre-RNA world, and time’, Cell, 85(6), pp. 793–798. doi: 10.1016/S0092-8674(00)81263-5.
Liao, J. B. (2006) ‘Cancer Issue: Viruses and Human Cancer’, The Yale Journal of Biology and Medicine, 79(3–4), p. 115. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1994798/.
Lineweaver, C. H. (2001) ‘An Estimate of the Age Distribution of Terrestrial Planets in the Universe: Quantifying Metallicity as a Selection Effect’, Icarus, 151(2), pp. 307–313. doi: 10.1006/icar.2001.6607.
Liu, H. et al. (2016) ‘A Facile Chemical-Free and Universal Method for Transfer of Ultrathin Graphene-Based Films’, Advanced Materials Interfaces, 3(18). doi: 10.1002/admi.201600540.
Margulis, L. (1992) ‘Biodiversity: molecular biological domains, symbiosis and kingdom origins’, BioSystems, 27(1), pp. 39–51. doi: 10.1016/0303-2647(92)90045-Z.
Martin, D. and Gutkind, J. S. (2008) ‘Human tumor-associated viruses and new insights into the molecular mechanisms of cancer’, Oncogene. Nature Publishing Group, 27, pp. S31–S42. doi: 10.1038/onc.2009.351.
Mayr, E. (1974) ‘Cladistic analysis or cladistic classification?’, Journal of Zoological Systematics and Evolutionary Research, 12(1), pp. 94–128. doi: 10.1111/j.1439-0469.1974.tb00160.x.
McIntyre, S. R. N., et al. (2019) ‘Planetary magnetism as a parameter in exoplanet habitability’, Monthly Notices of the Royal Astronomical Society. Oxford University Press, 485(3), pp. 3999–4012. doi: 10.1093/mnras/stz667.
Mcnichol, J. C. et al. (2012) ‘Jesse C. McNichol’. doi: 10.1007/978-94-007-2941-4.
Moelling, K. and Broecker, F. (2021) ‘Viroids and the origin of life’, International Journal of Molecular Sciences, 22(7), pp. 1–13. doi: 10.3390/ijms22073476.
Monod, J. El Azar y La Necesidad. 2016. TUSQUETS EDITORES. ISBN: 9788490662120 (Obra original publicada en: 1970).
Montmerle, T. et al. (2006) ‘Solar system formation and early evolution: The first 100 million years’, Earth, Moon and Planets, 98(1–4), pp. 39–95. doi: 10.1007/s11038-006-9087-5.
Montoya-Herrera, F. L. (1988) ‘No Titleآبهای زیرزمینی’, آب و خاک, 19(31), pp. 21–38.
n, Eunsung Mouradian, M. M. (2008) ‘基因的改变NIH Public Access’, Bone, 23(1), pp. 1–7. doi: 10.1016/j.tibs.2009.01.005.Co-evolution.
News, F. (2018) ‘Cataclysm’s End’, Nature News. Available at: https://www.nature.com/magazine-assets/d41586-018-01074-6/d41586-018-01074-6.pdf.
Penny, D., Hendy, M. D. and Steel, M. A. (1992) ‘Progress with methods for constructing evolutionary trees’, Trends in Ecology and Evolution, 7(3), pp. 73–79. doi: 10.1016/0169-5347(92)90244-6.
Peplies, J. et al. (2008) ‘A standard operating procedure for phylogenetic inference (SOPPI) using (rRNA) marker genes’, Systematic and Applied Microbiology, 31(4), pp. 251–257. doi: 10.1016/j.syapm.2008.08.003.
Podani, J. (2019) ‘The Coral of Life’, Evolutionary Biology. Springer US, 46(2), pp. 123–144. doi: 10.1007/s11692-019-09474-w.
Saladino, R. et al. (2018) ‘Rewarming the Primordial Soup: Revisitations and Rediscoveries in Prebiotic Chemistry’, ChemBioChem, 19(1), pp. 22–25. doi: 10.1002/cbic.201700534.
Scheller, E. L. et al. (2021) ‘Long-term drying of Mars by sequestration of ocean-scale volumes of water in the crust’, Science, 372(6537), pp. 56–62. doi: 10.1126/science.abc7717.
Schopf, J. W. (1993) ‘Microfossils of the early Archean apex chert: New evidence of the antiquity of life’, Science, 260(5108), pp. 640–646. doi: 10.1126/science.260.5108.640.
Spalding, C. and Fischer, W. W. (2019) ‘A shorter Archean day-length biases interpretations of the early Earth’s climate’, Earth and Planetary Science Letters, 514, pp. 28–36. doi: 10.1016/j.epsl.2019.02.032.
Stanley L. Miller (1953) ‘Miller-Science-1953.pdf’, Science, pp. 528, 529. Available at: http://www.chm.bris.ac.uk/motm/glycine/Miller-Science-1953.pdf.
Syvanen, M. (2002) ‘Rates of ribosomal RNA evolution are uniquely accelerated in Eukaryotes’, Journal of Molecular Evolution, 55(1), pp. 85–91. doi: 10.1007/s00239-001-2306-9.
Tsukuda, M., et al. (2017) ‘Comparative RNA function analysis reveals high functional similarity between distantly related bacterial 16 S rRNAs’, Scientific Reports. Springer US, 7(1), pp. 1–8. doi: 10.1038/s41598-017-10214-3.
Wächtershäuser, G. (2007) ‘On the chemistry and evolution of the pioneer organism’, Chemistry and Biodiversity, 4(4), pp. 584–602. doi: 10.1002/cbdv.200790052.
Wagner, K. et al. (2021) ‘Imaging low-mass planets within the habitable zone of α Centauri’, Nature Communications, 12(1), pp. 1–7. doi: 10.1038/s41467-021-21176-6.
Waller, W. H. (2019) ‘Life in the Milky Way’, The Milky Way, 303(January), pp. 251–276. doi: 10.2307/j.ctt28556v.16.
Weiss, M. C. et al. (2016) ‘The physiology and habitat of the last universal common ancestor’, Nature Microbiology. Nature Publishing Group, 1(9), pp. 1–8. doi: 10.1038/nmicrobiol.2016.116.
Woese, C. (1998) ‘The universal ancestor’, Proceedings of the National Academy of Sciences of the United States of America, 95(12), pp. 6854–6859. doi: 10.1073/pnas.95.12.6854.
Woese, C. R., et al. (1990) ‘Towards a natural system of organisms: Proposal for the domains Archaea, Bacteria, and Eucarya’, Proceedings of the National Academy of Sciences of the United States of America, 87(12), pp. 4576–4579. doi: 10.1073/pnas.87.12.4576.
Yarza, P. et al. (2008) ‘The All-Species Living Tree project: A 16S rRNA-based phylogenetic tree of all sequenced type strains’, Systematic and Applied Microbiology, 31(4), pp. 241–250. doi: 10.1016/j.syapm.2008.07.001.
Zahnle, K., Schaefer, L. and Fegley, B. (2010) ‘Earth’s earliest atmospheres.’, Cold Spring Harbor perspectives in biology, 2(10), pp. 1–17. doi: 10.1101/cshperspect.a004895.
Zubarev, R. A. (2011) ‘Role of stable isotopes in life-testing isotopic resonance hypothesis’, Genomics, Proteomics and Bioinformatics. Genomics, Proteomics & Bioinformatics, 9(1–2), pp. 15–20. doi: 10.1016/S1672-0229(11)60003-X.

