¿Qué pasaría si fueses al médico y te dijese que tu enfermedad solo la tiene 1 de cada 5.000 personas? ¿Qué dificultades supondría tener una enfermedad tan poco frecuente? Los pacientes con una enfermedad rara se enfrentan diariamente a diferentes dificultades causadas por la baja prevalencia de su patología.
¿Qué son las enfermedades raras?
Las enfermedades raras, también conocidas como “enfermedades poco frecuentes”, son afecciones presentes en un porcentaje muy pequeño de la población. En algunos países, como es el caso de España, una enfermedad se considera “rara” si afecta a menos de 1 de cada 2 000 personas. Sin embargo, este valor varía dependiendo de cada país. Por ejemplo, en el caso de Estados Unidos, una enfermedad es “rara” si afecta a menos de 200 000 habitantes del país.
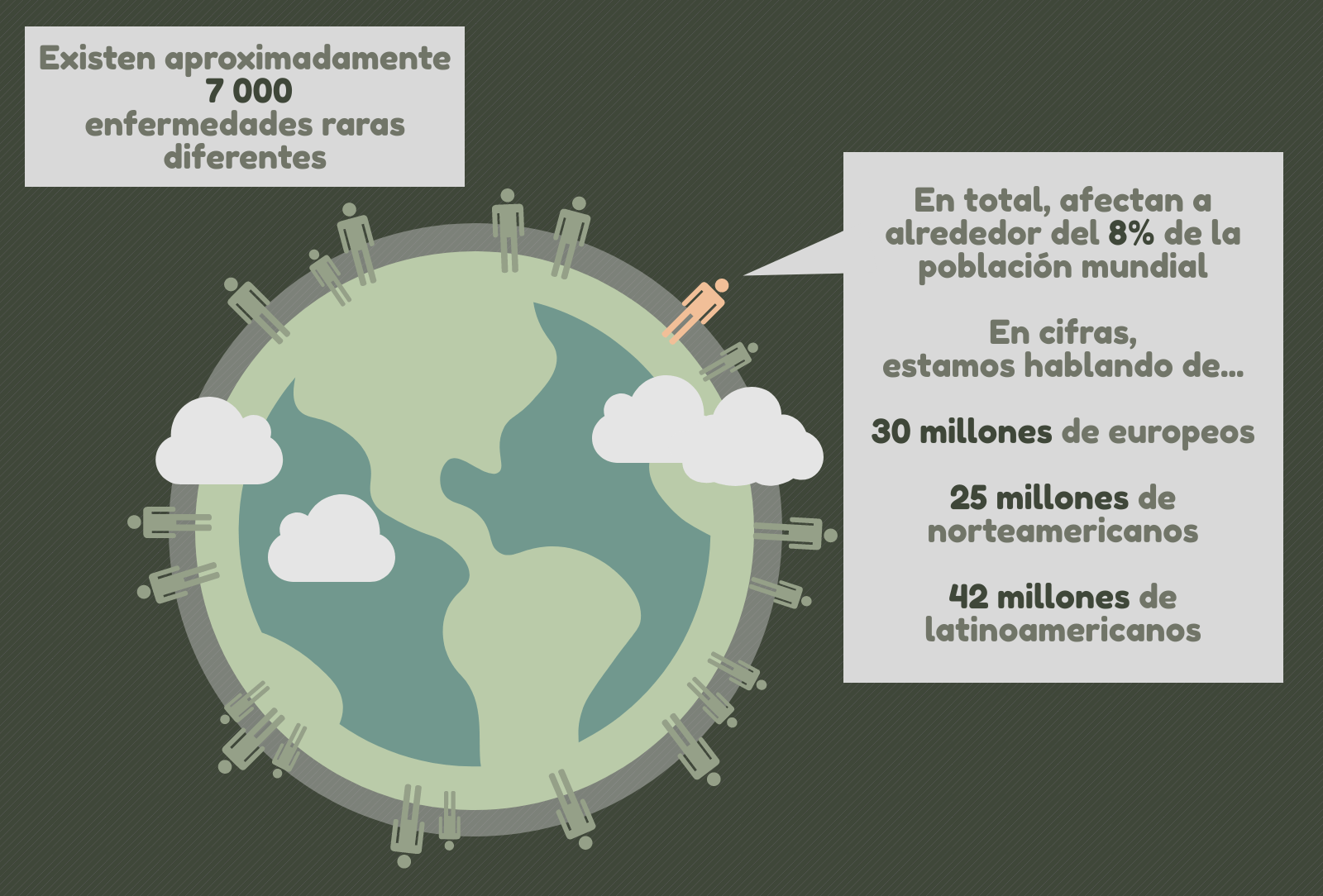
Las enfermedades raras suelen pasar desapercibidas, debido a su baja prevalencia. No obstante, en conjunto, afectan a alrededor del 8% de la población mundial. En cifras, estamos hablando de más de 30 millones de europeos (más 3 millones de ellos con nacionalidad española), 25 millones de norteamericanos y 42 millones de iberoamericanos.
La importancia de la genética en las enfermedades raras
Hablar de enfermedades raras es prácticamente lo mismo que hablar de enfermedades genéticas poco frecuentes. A día de hoy, se han descrito casi 7 000 enfermedades raras diferentes, de las cuales una mayoría (aproximadamente el 80%) son de origen genético. Dado el alto porcentaje de enfermedades raras que tienen una causa genética, es inconcebible pasar por alto el importante papel de la genética en el diagnóstico y la investigación de las enfermedades raras. La genética es una herramienta indispensable también en el asesoramiento de las familias con pacientes con enfermedades raras.
Además, la Genética y la Genómica juegan un papel esencial en el desarrollo de tratamientos para las enfermedades raras. Actualmente existen diferentes enfoques, basados en la utilización de moléculas pequeñas, anticuerpos y oligonucleótidos, entre otros, en los que estas disciplinas son esenciales. Puedes leer más sobre avances en los tratamientos de las enfermedades raras en el post que tenemos al respecto

Algunas de las enfermedades raras de origen genético más frecuentes son el síndrome del X-frágil, el síndrome de Marfan o el síndrome de Prader-Willi. La primera de ellas, el síndrome del X-frágil, afecta a aproximadamente 1 de cada 4.000 hombres y 1 de cada 6.000 mujeres en todo el mundo. El síndrome de Marfan afecta a 3 personas de cada 10.000 y el síndrome de Prader-Willi a aproximadamente 1 de cada 15.000 nacidos vivos. Otras enfermedades, son muchísimo menos comunes. Por ejemplo, se estima que únicamente 200 personas en todo el mundo presentan la enfermedad de los cuerpos de Lafora, una enfermedad neurodegenerativa que afecta al sistema nervioso.
Diagnóstico: el primer contacto con una enfermedad rara
Cuando una persona ve alterado su estado de salud, una de las primeras acciones que toma es acudir a la consulta del médico. En el caso de las enfermedades raras sucede lo mismo, pero con algunas trabas. La baja frecuencia con la que se presentan y la gran variabilidad en la sintomatología puede retrasar el diagnóstico hasta una media de 5 años desde la aparición de los primeros síntomas.
Afortunadamente, el desarrollo de las diferentes técnicas de diagnóstico genético está acelerando y facilitando la identificación de las enfermedades raras causadas por mutaciones en el ADN. Algunas de las herramientas genéticas que han tenido un mayor papel dentro del diagnóstico de enfermedades raras en los últimos años son las plataformas de NGS (Secuenciación de Nueva Generación) y el array CGH (Hibridación Genómica Comparativa). Dentro de las plataformas de NGS, existe un gran abanico de aproximaciones posibles que pueden ser utilizadas para el diagnóstico de pacientes con enfermedades raras.
En primer lugar, encontramos la secuenciación WGS (del inglés Whole Genome Sequencing), una estrategia de secuenciación que abarca el genoma nuclear y mitocondrial completo del individuo. Este tipo de estudios son muy interesantes, ya que proporcionan una imagen completa y detallada de todo el genoma de un individuo. Actualmente esta estrategia es utilizada principalmente en el ámbito de la investigación, ya que tiene un coste elevado y se necesitan secuenciadores de alto rendimiento.
En segundo lugar, encontramos una estrategia más asequible para los laboratorios y hospitales españoles, la secuenciación WES (del inglés Whole Exome Sequencing). Este tipo de secuenciación abarca todo el exoma (la parte codificante del genoma) de un individuo, que corresponde a, aproximadamente, el 1,5% del genoma humano. La ventaja principal de este tipo de secuenciación frente a la secuenciación WGS es que, debido a que se secuencia mucho menos ADN, el coste económico se ve reducido. Además, los análisis de WES son más sencillos de interpretar.
Otra de las aproximaciones más comunes en secuenciación NGS es la secuenciación de paneles de genes. Este tipo de secuenciación es mucho más concreta, ya que comprende el estudio de un determinado grupo de genes de interés. La principal ventaja de este tipo de secuenciación es, por una parte, que es más económica y, por otra, que su profundidad de lectura (nº de veces que se secuencia cada fragmento de ADN. Indicador de calidad) es mayor. Normalmente la secuenciación de paneles de genes se utiliza cuando hay sospecha de que la mutación responsable de la enfermedad puede estar dentro de un grupo de genes concretos. Actualmente existe un gran número de paneles comerciales e incluso se pueden solicitar paneles de genes personalizados que cubran cierto tipo de enfermedades.
Por último, entre las técnicas más comunes encontramos la secuenciación WTS (del inglés Whole Transcriptome Sequencing), también conocida como RNAseq o Secuenciación del Transcriptoma. Este tipo de secuenciación se realiza sobre el transcriptoma, es decir, el ARN transcrito que se traducirá finalmente a proteínas. Esto permite obtener una información global de los genes que expresa un individuo en un determinado momento, lo que puede ayudar a identificar aspectos post-transcripcionales que ocurren en una enfermedad rara. El principal problema de la secuenciación WTS es que sus análisis son mucho más complejos que el resto y se necesitan expertos bioinformáticos para poder interpretarlos.
Existen otras aproximaciones para el diagnóstico de enfermedades raras basadas en la epigenómica, la proteómica, la metabolómica y otras técnicas -ómicas. En el siguiente artículo puedes leer más al respecto.
Investigación de enfermedades raras
Al igual que sucede en el caso del diagnóstico de enfermedades raras, los recientes avances en el campo de la Genética y la Genómica están siendo de gran ayuda en la investigación de las enfermedades raras de origen genético. Gracias a la genética, los investigadores pueden crear modelos celulares y animales en los que estudiar las enfermedades raras. Estos modelos permiten comprender mejor los mecanismos y causas de estas enfermedades, así como a buscar qué tratamientos pueden ser de interés.
Actualmente se están investigando alrededor del 20% de todas las enfermedades raras que se conocen. Esta cifra se debe principalmente al reducido número de pacientes que se encuentran afectados por cada una de ellas. Los investigadores necesitan material de estudio para poder sacar conclusiones y la baja prevalencia de cada una de las enfermedades raras dificulta sobremanera este trabajo.
Otra de las principales limitaciones en la investigación de las enfermedades raras es la falta de financiación. Las farmacéuticas no suelen estar interesadas ni en financiar la investigación de medicamentos dirigidos a enfermedades raras ni mucho menos en comercializarlos, lo que dificulta el desarrollo de nuevos tratamientos. En muchos casos, además, cuando se consigue investigar y desarrollar un tratamiento para una enfermedad rara, su precio es poco asequible para el mercado privado y difícilmente asumible para los sistemas de salud públicos, por lo que no son realmente accesibles para las familias afectadas.
Afortunadamente, en los últimos años se han desarrollado diferentes ayudas y subvenciones que apoyan la investigación de enfermedades raras, así como el desarrollo de fármacos específicos para tratarlas. Es el caso del desarrollo de medicamentos huérfanos.
Medicamentos huérfanos: una incentiva para la investigación de enfermedades raras
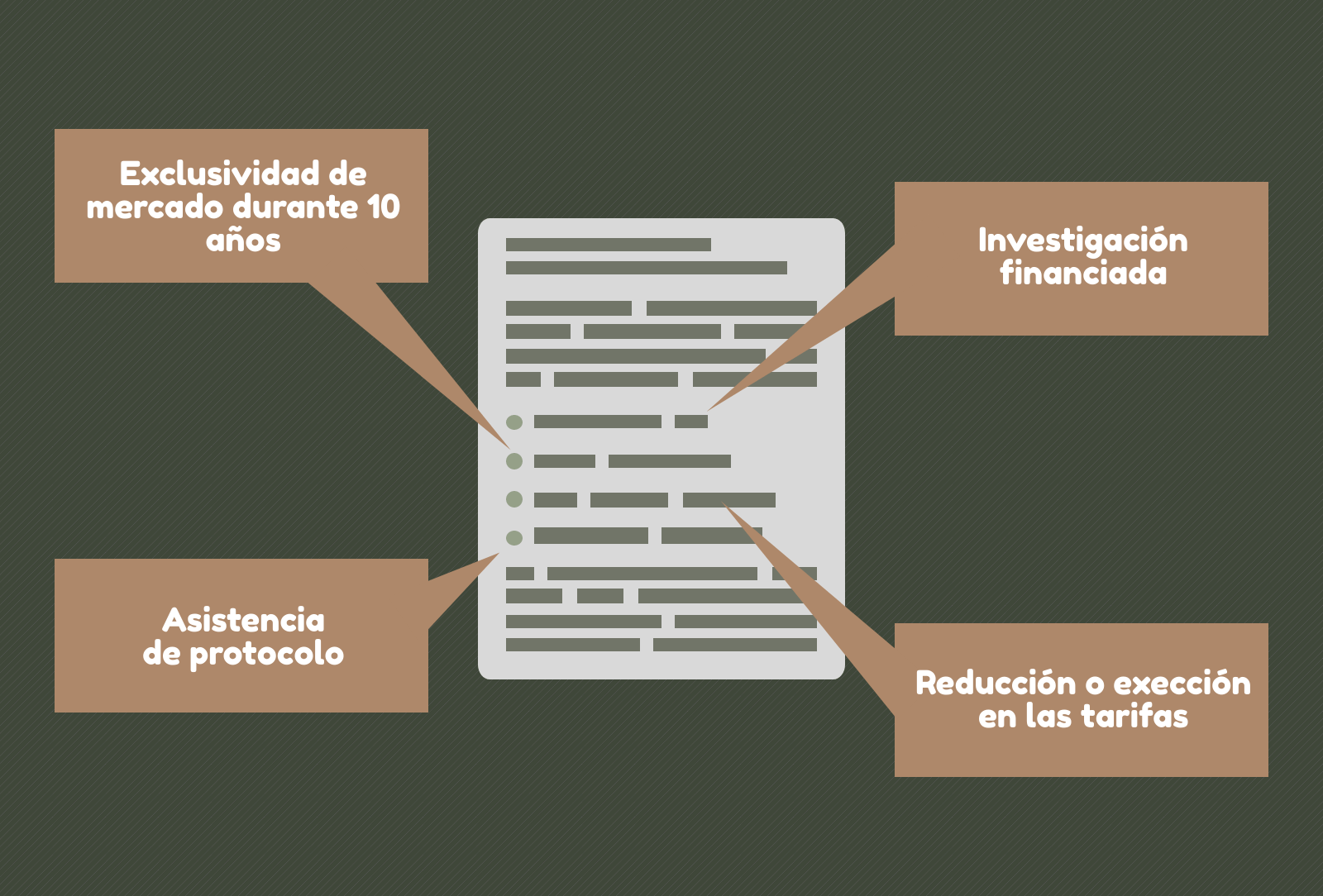
En 1983 se aprobó en Estados Unidos el primer Acta de Medicamentos Huérfanos, que incentivaba la investigación de fármacos para tratar enfermedades raras. Gracias a esta nueva legislación, aquellas empresas estadounidenses que estuviesen desarrollando un medicamento de este tipo, obtendrían una protección de patente y derechos de comercialización mejorados, así como subvenciones. En Europa, las autoridades sanitarias ofrecen desde el año 1999 los siguientes incentivos a aquellas empresas que desarrollen un medicamento huérfano
-
- Exclusividad en el mercado durante 10 años después de haber sido aprobados (12 en caso de medicamentos pediátricos).
- Investigación financiada por la Unión Europea.
- Asistencia de protocolo por parte de la Agencia Europea de Medicamentos.
- Reducción o exención en las tarifas durante el procedimiento
Si te ha gustado este blog y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos, como el de «Genómica en Enfermedades Raras«, y formación universitaria, así como nuestro canal audiovisual, Genotipia TV.

