Rubén Megía González
ATENCIÓN
SPOILERS DE ALIEN: EL OCTAVO PASAJERO
EN ESTE BLOG LA TENIENTE RIPLEY RESPONDE FISIOLÓGICAMENTE COMO UN CONJUNTO DE ORGANISMOS MODELO HIBERNADORES Y NO NECESARIAMENTE COMO LO HARÍA UN HUMANO REAL.

Año 2122. Una nave comercial ha sufrido un accidente tras volver del planeta Thedus. De los siete miembros que se enviaron en la nave espacial, la única superviviente es la teniente Ellen Louise Ripley, encontrada junto a un pequeño felino en una cámara de hipersueño, en estado de hibernación. Sabiendo que, al igual que el resto de humanos mortales, ahora mismo soy incapaz de entrar en un estado de hibernación por mucho que lo intente, ¿Cómo es posible que la teniente Ripley hiberne? ¿Se trata de una estrategia evolutiva que adquirieron los humanos del año 2122? Para entenderlo mejor, hay que definir primero qué es la hibernación.
¿Qué es la hibernación?
Por definición, la hibernación es la capacidad que tienen algunas especies de animales de entrar en un estado de letargo mantenido que se da en la época invernal y que les permite sobrevivir a unas condiciones de alimento escaso y temperaturas bajas. Ese estado de letargo consigue reducir hasta en un 90% el gasto energético en algunas especies.
Así pues, Ripley, al igual que su gato, tras la primera película se encontraría en un estado de bajo metabolismo en el que su temperatura corporal no sería mantenida por homeotermia, es decir, su temperatura corporal se mantendría similar a la temperatura ambiental.
Podría explicar muchos de los procesos fisiológicos que estarían dándose en el organismo de la teniente, pero como estamos en un blog de genética, os explicaré qué sucedería con el genoma de Ripley.
¿Qué sucede con el genoma de Ripley?
Obviando que ninguno de los estudios que se han realizado ha sido comprobado en humanos por cuestiones éticas, lo que se observaría en una hipotética persona humana que respondiese a la hibernación igual que lo harían los animales modelo estudiados en laboratorio sería una expresión génica extremadamente baja. Diversos estudios han comprobado que, durante la hibernación, el genoma se transcribe muy poco. Pero no todo el genoma. Hay genes que se transcriben de forma activa, mientras que otros no se transcriben absolutamente nada.
Un ejemplo de alta actividad transcripcional durante la hibernación se da en los genes que dan lugar a proteínas transportadoras de ácidos grasos (FABPs). La actividad de los genes FABP se ve regulada por unos factores de transcripción que denominamos PPARγ. Se observa una gran diversidad en la familia de genes FABP y, aunque la función de las proteínas FABP es similar, cada gen puede estar localizado en diferentes cromosomas.
Dado que los ácidos grasos son la principal fuente energética durante el periodo de inactividad que supone la hibernación, es comprensible que los genes de la familia FABP estén sobreexpresados. De hecho, la mayoría de animales ingieren una cantidad superior a la normal de alimentos justo antes de la hibernación. A este comportamiento se le denomina hiperfagia.
Otros genes que sufren un aumento de hasta 4 veces en sus niveles de transcripción durante el periodo de hibernación son el gen Cox1 y algunos genes mitocondriales como MT-ATP6. Se cree que la alta actividad de estos genes es esencial para la minimización del daño causado a la cadena de transporte de electrones por las bajas temperaturas.
¿Cómo se regula la expresión génica durante la hibernación?
Se cree que la epigenética podría estar implicada en los mecanismos de regulación transcripcional de diferentes genes relacionados con la hibernación. Según esta hipótesis, durante los periodos de baja actividad los genes específicos del proceso de hibernación se encontrarían hipometilados, aumentando su actividad transcripcional. En cambio, los genes no específicos del proceso de hibernación se encontrarían hipermetilados y muy poco activos.
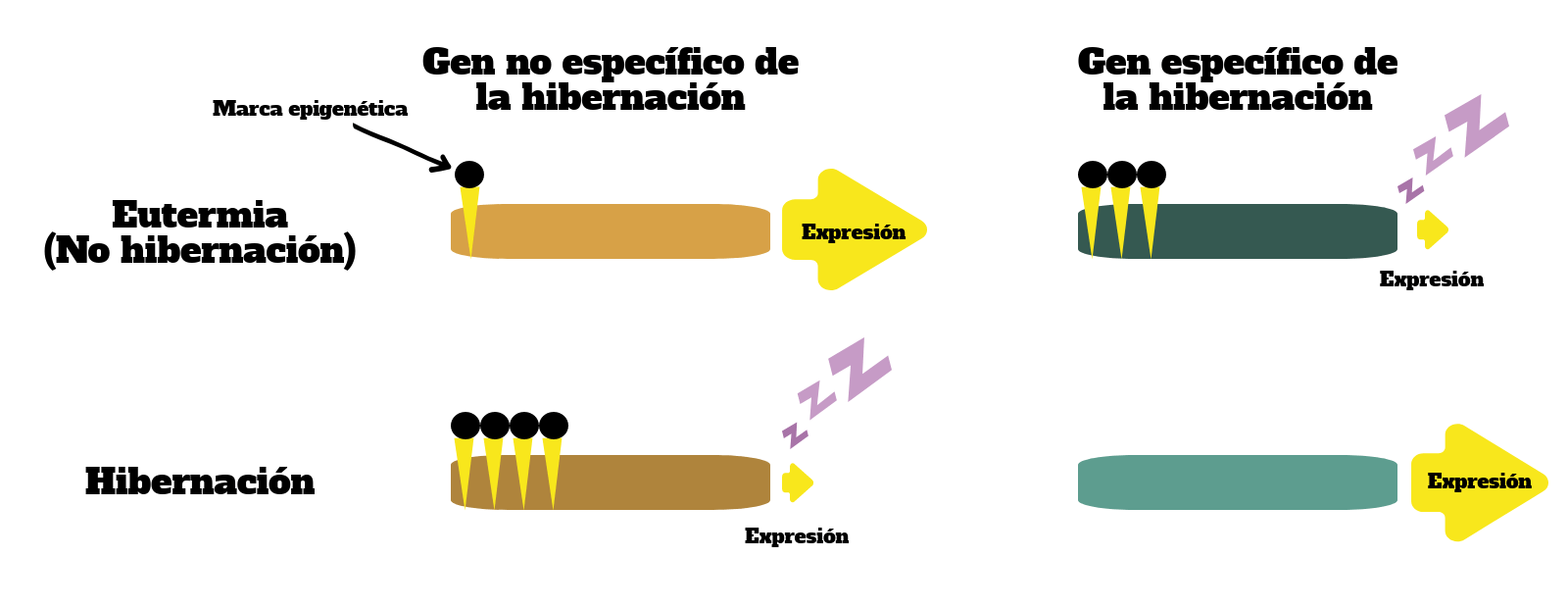
La hipótesis más aceptada actualmente implica la actuación de mi-ARNs para regular la expresión génica. Los mi-ARNs, también conocidos como micro-ARNs, son fragmentos cortos de ARN de entre 21 y 25 nucleótidos que participan en la regulación de la traducción de ARN a proteínas. Concretamente, los mi-ARNs interfieren en la lectura de los fragmentos de ARN mensajero, impidiendo su traducción por parte de los ribosomas.
Esto es básicamente lo que ocurriría con el genoma de la teniente Ripley en el caso de que actuase de igual forma que los animales hibernantes que conocemos. Ahora la pregunta es, ¿Qué determina que Ripley entre en hibernación? En otras palabras, ¿Cómo es posible inducir un proceso de hibernación?
Aunque los últimos estudios en lémures hibernantes indican que el genoma de nuestra especie tiene la información necesaria para accionar los mecanismos moleculares necesarios para hibernar, el ser humano no es capaz de iniciar, mantener y salir de un estado de letargo como es la hibernación. Con esto en mente, se han buscado diferentes moléculas inductoras de la hibernación como el sulfuro de hidrógeno (H2S), el 5’Adenosin monofosfato o el opioide D-Ala(2)-D-Leu(5)-encefalina (DADLE). Estos compuestos han sido testados en diferentes animales y, aunque no se sabe su efecto en humanos, se piensa en ellos como una posible forma de inducción de la hibernación humana en un futuro.
Hemos de suponer, pues, que en el futuro que nos muestra la saga Alien, los humanos hemos sido capaces de diseñar una cámara de hipersueño que puede inducir un estado de hibernación mediante algún tipo de sustancia. Pero no solo eso. La cámara de hipersueño también sería capaz de mantener el estado de letargo y finalizarlo en el momento indicado sin afectar de forma negativa al organismo del ser humano.
¿Para qué queremos hibernar?
Como habéis podido comprobar, las películas basadas en viajes espaciales siempre disponen de algún tipo de cámara de hibernación. Pensad que si disminuimos la actividad corporal y, por tanto, el metabolismo, podemos viajar durante mucho más tiempo consumiendo una ínfima parte de los recursos necesarios para el viaje en un estado metabólico normal. También reduciremos el daño oxidativo y el envejecimiento. Gracias a esto, podríamos llevar a cabo viajes espaciales de larga duración con un gasto de recursos mínimos y con la tripulación que inició el viaje pero, ¿es este el único motivo por el que el ser humano quiere dominar el arte de la hibernación? Obviamente, no.
Aunque se hable mucho de viajes espaciales, estos son solo una de las aplicaciones de la hibernación en humanos. En el ámbito de la medicina, por ejemplo, la utilización de una estrategia como es la hibernación podría suponer grandes avances. Pensad en la de analgésicos que se ahorrarían en los hospitales si se pudiera inducir un estado de hibernación en los pacientes que van a ser intervenidos quirúrgicamente, por no hablar de lo sencilla que sería la conservación prolongada de órganos en “hibernación” a bajas temperaturas.
Desde luego, la hibernación tiene muchas aplicaciones para el ser humano, pero desafortunadamente no se conocen al detalle los mecanismos que permiten en otros organismos la inducción, mantenimiento y salida del estado hipometabólico de hibernación. Es por eso que la hibernación es una estrategia evolutiva que aún está muy lejos de ser aplicada en humanos. Incluso en la fantástica teniente Ellen Louise Ripley.
¡Y hasta aquí todo por hoy! Nos leemos en el próximo post.
Bibliografía interesante:
-Morin P. & Storey K. B. 2009 Mammalian hibernation: differential gene expression and novel application of epigenetic controls. Int. J Dev Biol 53, 433-442
-Singer D. 2006 Human Hibernation for Space Flight – Utopistic Vision or Realistic Possibility. JBIS 59,139-143
-Osborne P. G., Gao B. & Hashimoto M. 2004 Determination in vivo of newly synthesized gene expression in hamsters during phases of the hibernation cycle. Jpn J Physiol 54(3), 295-305.
-Bocharova L. S., Gordon R. Y. & Arkhipov V. I. 1992 Uridine uptake and RNA synthesis in the brain of torpid and awakened ground squirrels. Comp Biochem Physiol B 101(1-2),189-192.
-Eddy S. F, & Storey K. B. 2004. Up-regulation of fatty acid-binding proteins during hibernation in the little brown bat, Myotis lucifugus. Biochim Biophys Acta 1676(1), 63-70
-Crawford F. I., Hodgkinson C. L., Ivanova E., Logunova L. B., Evans G. J., Steinlechner S. & Loudon A. S. 2007 Influence of torpor on cardiac expression of genes involved in the circadian clock and protein turnover in the Siberian hamster (Phodopus sungorus). Physiol Genomics 31(3), 521-530
-Yuan L., Geiser F., Lin B., Sun H., Chen J. & Zhang S. 2015 Down but Not Out: The Role of MicroRNAs in Hibernating Bats. PLoS One 10(8).https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0135064



