INTRODUCCIÓN
Los enormes avances producidos en las últimas décadas, tanto en los conocimientos como en las tecnologías de la Genética Humana y la Genética Médica, han supuesto la necesidad de una elevada especialización. Esta superespecialización, que ha sucedido en muchos otros ámbitos de la ciencia, implica asumir una perspectiva cada vez más estrecha y próxima al campo de estudio, a costa de sacrificar una visión más global e integradora. En otras palabras, los árboles no dejan ver el bosque. En este sentido, es muy conveniente abrir el foco y plantear un análisis reflexivo desde las aportaciones de la Filosofía de la Ciencia en general y los aspectos específicos de las Filosofías de la Biología y la Medicina (Griffiths y Stotz, 2013; Falk, 2015).
Aunque las reflexiones sobre la herencia biológica son muy antiguas y fueron esenciales los experimentos de Mendel en el siglo XIX, la Genética, como disciplina científica, es relativamente joven y es sorprendente que sus aplicaciones médicas aun presentan una consolidación precaria en algunos países, como el nuestro (García Díaz, 2023). En su desarrollo acelerado se pueden identificar algunas etapas (Meunier, 2023) (Figura 1).
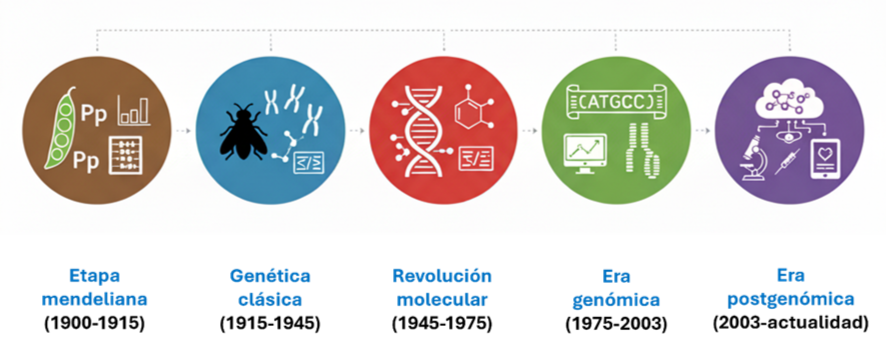
– Etapa mendeliana (1900-1915), que surge por el redescubrimiento de los trabajos de Mendel, la consolidación de los conceptos de dominancia, recesividad y segregación independiente y el desarrollo de rigurosos métodos experimentales cuantitativos.
– Genética clásica (1915-1945), surge tras los trabajos de Morgan con la Drosophila y la identificación de los cromosomas como continentes de los genes y la introducción de conceptos como ligamiento, recombinación y mutación.
– Revolución molecular (1945-1975), con el descubrimiento de la estructura del ADN por Watson y Crick y la identificación del código genético, a la vez que se desarrolla la genética bioquímica; además, en 1959 se descubrió que el síndrome de Down se debía a la presencia de una trisomía 21, que supuso establecer por primera vez la causa cromosómica de una discapacidad intelectual y la incorporación del cariotipo como técnica de diagnóstico genético en medicina.
– Era genómica (1975-2003), en que se desarrollan y perfeccionan las tecnologías de secuenciación y se inicia la aplicación de métodos computacionales para los análisis genéticos, con la culminación del Proyecto Genoma Humano.
– Era postgenómica (2003-actualidad), en la que se consolidan las técnicas analíticas de alto rendimiento, tanto la secuenciación masiva del ADN (NGS) como las demás ómicas, cuya ingente producción de datos conlleva la necesidad de la bioinformática. En ésta se ha desplazado al gen, como centro principal de interés, hacia su interacción con múltiples sistemas biológicos, y surgen los desarrollos orientados a la Medicina Personalizada o de Precisión y las terapias y edición génica.
Para asimilar de forma adecuada todos estos avances y transformaciones vertiginosas es conveniente plantearse algunas cuestiones: ¿cuál es la naturaleza real de los conceptos habituales que utilizamos en Genética?, ¿cómo adquirimos los conocimientos precisos sobre los fenómenos genéticos y establecemos entre ellos relaciones de causalidad?, ¿qué retos plantean las tecnologías, cada vez más poderosas, en términos éticos y de respeto a los derechos de los individuos? La ontología, la epistemología y la bioética son las tres ramas de la Filosofía que tratan de responder, respectivamente, a estas preguntas.
ONTOLOGÍA Y GENÉTICA
Naturaleza del gen
La genética clásica, inspirada en los trabajos de Mendel, conceptualizó el gen como un factor hereditario abstracto y discreto responsable de un carácter específico. Este modelo fue reforzado por el descubrimiento de la estructura del ADN y la formulación del Dogma Central de la Biología Molecular (Camacho, 2021). Así, la definición molecular de gen consiste en una secuencia de ADN que codifica productos funcionales. Esta perspectiva, que puede describirse como reduccionismo metodológico, ha permitido un desarrollo teórico muy importante (Pearson, 2006).
Sin embargo, la era postgenómica y los avances en biología molecular han revelado una realidad mucho más compleja. Fenómenos como el splicing alternativo, el solapamiento de genes, las regiones reguladoras extragénicas y la regulación epigenética han mostrado que, en realidad, los genes son entidades dinámicas y altamente dependientes del contexto. Todo ello ha abierto un debate ontológico sobre si los genes son entidades naturales reales o meras construcciones conceptuales.
Además, la relación entre un fragmento de ADN y un rasgo fenotípico rara vez es directa, estable o unívoca. Así, se ha llegado a distinguir conceptos como el Gen-P (fenotípico, relacionado con los rasgos) y el Gen-D (molecular, definido por la secuencia de ADN) (Griffiths y Stotz, 2013). Ahora se reconoce que no existe una definición universal del gen y su significado depende en gran medida del contexto (factores citoplasmáticos, señales ambientales y relaciones celulares) y del nivel de análisis. Desde un punto de vista ontológico, el gen no se concibe ya como una unidad simple y estática, sino como un proceso plural y dinámico, que forma parte de un sistema biológico muy complejo (Griffiths y Neumann-Held, 1999).
Concepto de información genética
El concepto del gen como estructura portadora de información ha sido una metáfora científica muy exitosa y productiva. Sin embargo, el significado de la información contenida en el ADN no es inherente a la secuencia misma, sino que emerge a través de la estructura interna del sistema biológico y sus complejos mecanismos interpretativos, como la maquinaria de traducción de proteínas. Existe un debate sobre si la información genética posee propiedades semánticas (de significado) exclusivas o si es simplemente una correspondencia química.
La secuencia lineal de bases en los ácidos nucleicos (ADN y ARN) determina con exactitud la secuencia lineal de aminoácidos en una proteína. Esto es lo que se ha llamado ‘información de Crick’ y que él mismo denominó especificidad causal. Este concepto fue fundamental para el desarrollo de la biología molecular y su dogma central y se asociaba principalmente a las regiones codificantes del ADN y al flujo de información unidireccional.
Como se ha comentado antes para el conjunto del gen, ahora se ha superado la visión genocentrista y se entiende que la información genética está distribuida entre las secuencias codificantes, las marcas epigenéticas, las secuencias reguladoras, los productos de ARN y proteínas y las señales ambientales que actúan a través de la maquinaria celular reguladora (Donovan, 2022). De esta forma, la Información de Crick se reduciría a una forma simple de correspondencia bioquímica, pero insuficiente para explicar el conjunto del flujo de información.
Componentes de la herencia biológica
De igual manera, ahora se considera simplista la visión de que la herencia biológica reside sólo en las secuencias del ADN nuclear heredadas de los progenitores. En la comprensión actual de la herencia biológica se incluyen también la herencia epigénetica transgeneracional (distinta de la impronta, relacionada habitualmente con factores adversos del entorno en los progenitores y que persiste a pesar del borrado de marcas epigenéticas en la gametogénesis y la embriogénesis), factores citoplasmáticos del óvulo (entre los que destaca el ADN mitocondrial) y factores exogenéticos ambientales (desde la microbiota, hábitos, dieta, estilo de vida y otras circunstancias del entorno, que se han agrupado en el concepto de nicho de desarrollo) (Stotz, 2017). Todo ello hace que la perspectiva actual de la herencia biológica sea mucho más compleja, ya que intervienen todos los sistemas descritos de una forma interconectada. También así se justifica la ausencia descrita de una relación estable y unívoca entre las secuencias de ADN y los rasgos fenotípicos. Otra evidencia a favor de esta perspectiva pluralista es la eficiente transmisión de ciertos aspectos culturales y simbólicos, como el lenguaje, en los humanos.
Identidad biológica e individualidad
Los progresos en la biología molecular consolidaron el concepto de que la identidad biológica era una función directa de la información genética codificada en el ADN. En la era postgenómica los organismos
son considerados como sistemas biológicos con entidad propia, que están caracterizados por complejas relaciones internas, un desarrollo diferencial y específico asociado a su propia historia y una identidad emergente (Visscher, et al., 2008). Esto último implica que exhiben propiedades que no pueden explicarse únicamente por la suma de sus componentes moleculares (Hoedemaekers y Dekkers, 2002). De nuevo, se ha desarrollado un enfoque pluralista que supera el reduccionismo ontológico genocéntrico.
Tampoco se puede olvidar las interdependencias con otros organismos, entre ellos la variedad de la microbiota, que convierte a los individuos en holobiontes (un organismo anfitrión y su microbioma) (Skillings, 2016). Por otra parte, la plasticidad fenotípica también está condicionada por el ambiente (interacción GxE: Gene x Environment), en parte debido a las modificaciones epigenéticas adaptativas.
Ahora la identidad biológica y la individualidad deben entenderse como fenómenos o procesos dinámicos, relacionales y emergentes que trascienden las concepciones reduccionistas tradicionales (Pääbo, 2001). Así, la identidad residiría en la continuidad de los procesos organizativos y el metabolismo. Esta transformación ontológica conlleva una nueva mereología (relación entre la totalidad y sus partes) y tiene implicaciones profundas para la investigación biológica y la práctica médica. También supone una dificultad añadida para la llamada medicina personalizada.
Categorías taxonómicas y poblacionales
La aparición de la filogenómica (análisis de datos genómicos completos para reconstruir relaciones evolutivas) ha introducido un nuevo marco ontológico (Dickins, 2023), donde las especies se conceptualizan no como entidades discretas basadas en similitudes morfológicas, sino como linajes evolutivos caracterizados por patrones específicos de divergencia molecular (Salazar-Ciudad y Cano-Fernández, 2023). El concepto filogenómico de especie propone utilizar tanto análisis filogenéticos de genes menos conservados como análisis genómicos para la circunscripción de especies (Tickle y Urrutia, 2017). Esta aproximación ontológica implica que los árboles de diversificación genética no son idénticos a los árboles de especies. Un nodo interno en un árbol génico indica el punto en que un gen ancestral se diversificó y dio lugar a dos variantes con secuencias de ADN diferentes.
En cambio, en un árbol de especies, un nodo interno señala un evento de especiación, es decir, la separación de una población previa en dos linajes que evolucionan de forma independiente. Ni siquiera el aislamiento reproductivo se puede invocar para defender la idea clásica de especie por la observación de numerosos híbridos a lo largo de la evolución. Un criterio pragmático actual para considerar a individuos de la misma especie es si pueden engendrar descendientes fértiles. También se ha propuesto el fenómeno de la canalización genética para explicar la tendencia de los sistemas de desarrollo a producir resultados consistentes, a pesar de las variaciones genéticas o ambientales; lo que explicaría por qué los organismos de una misma especie son tan reconociblemente similares.
Por otra parte, la genética molecular y de poblaciones ha desmantelado también las bases biológicas de las clasificaciones raciales tradicionales (Phelan, et al., 2013; Mohsen, 2020), revelando que las diferencias genéticas entre poblaciones humanas son siempre diferencias en las frecuencias de los alelos. Los estudios genómicos han demostrado consistentemente que la mayoría de las diferencias se encuentran dentro de una misma población geográfica, no entre ellas (Yudell et al., 2016). Esta observación, en su formulación más radical, dio lugar a la llamada paradoja de Lewontin, que afirmó que el 85% de la variación genética en el ser humano ocurre entre individuos de la misma población y solo el 15% restante se debe a las diferencias entre distintas poblaciones (Edwards, 2003).
Aunque la magnitud de estas estimaciones ha sido criticada, hoy se considera que la raza es principalmente una construcción social, con débiles correlaciones genéticas, y carece de significado como categoría biológica discreta. Por ello, se prefiere ahora, aunque también con ciertas objeciones, el eufemismo grupo étnico, por no tener la misma carga histórica y social. En la misma línea, los estudios de ascendencia, que se han hecho muy populares, también plantean interrogantes sobre su precisión y el riesgo de reforzar identidades esencialistas. En la mayoría de las poblaciones humanas los individuos poseen ascendencia de múltiples poblaciones fuente, cada vez más diversa, lo que se ha llamado entropía de la mezcla genética. La identidad genética debe entenderse en términos de particulares demográficos históricos y relaciones genealógicas (modelos de ancestralidad continua), más que de tipos concretos o específicos (Domingue y Belsky, 2017).
EPISTEMOLOGÍA Y GENÉTICA
Modelos de causalidad en Genética
En las etapas clásicas de la Genética (mendelismo y morganismo) el modelo causal en las relaciones de sus elementos era fundamentalmente mecanicista y esencialista: los genes eran considerados como partículas físicas discretas y la relación entre genotipo y fenotipo solía presentarse como directa y unívoca (Tsou, 2006). En las eras genómica y postgenómica la causalidad ha evolucionado hacia modelos probabilísticos y sistémicos (Gannett, 1999; Holliday, 1999). Los conceptos de penetrancia incompleta y expresividad variable introdujeron una causalidad probabilística. La causa (genotipo) aumenta la probabilidad de un efecto (fenotipo), pero no lo garantiza. Esto se aleja del determinismo clásico y se acerca a modelos estadísticos. Un gen puede afectar a múltiples caracteres (pleiotropía) y un carácter puede ser influido por muchos genes (poligenia). La causalidad deja de ser lineal y se convierte en reticular (en red) y multifactorial (especificidad causal distribuida). No hay una causa única, sino un conjunto de condiciones necesarias, pero no suficientes.
Además, la epigenética y el estudio de la regulación génica muestran que la actividad de un gen está causalmente influida por su contexto (otros genes con efecto modulador o epistático y factores ambientales). De esta manera, la causalidad es también circular y recursiva (los productos de los genes regulan a otros genes, incluidos a veces a sí mismos), desdibujando la línea entre causa y efecto.
Desde el punto de vista de la filosofía de la ciencia, la causalidad genética ha evolucionado desde una perspectiva determinista y reduccionista, limitada a leyes fisicoquímicas, hacia el llamado emergentismo (propiedades de un todo superiores a la de la suma de las partes), caracterizado por una causalidad probabilística, sistémica y multinivel (Brigandt, 2010). Así, se supera la clásica dicotomía entre naturaleza (nature) y crianza (nurture): los genes y el ambiente no son causas que compitan, sino que son componentes inseparables de un sistema causal único (Pigliucci, 2001). Los genes permiten la respuesta al ambiente y el ambiente desencadena y modula la expresión génica. El concepto de norma de reacción (rango de fenotipos que un genotipo puede producir en diferentes ambientes) recoge esta interacción causal (Figura 2). Todo esto no debilita el papel de la Genética, sino que refleja su madurez como ciencia, capaz de abordar la complejidad de los seres vivos (Zucker, 1981).
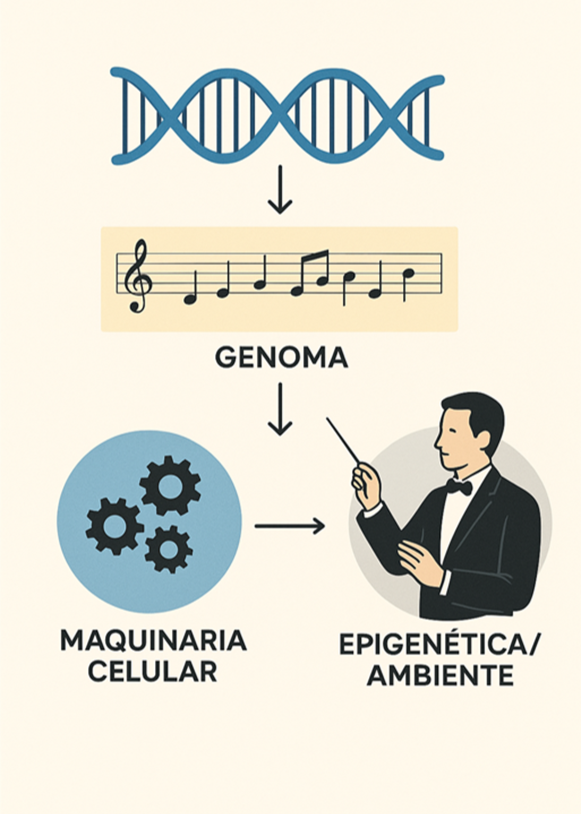
Relación genotipo-fenotipo en la era postgenómica
La confirmación de que en el genoma humano hay solo alrededor de 20.000 genes, muchos menos de los esperados para un organismo tan complejo, fue una evidencia en contra de que el genoma era un simple plano o libro de instrucciones. Como ya se ha comentado en los apartados previos, las secuencias de ADN no se leen de forma pasiva, sino que son interpretadas por la maquinaria celular. Esta interpretación está sujeta a variaciones (epigenética, factores de transcripción, splicing alternativo). Por lo tanto, el fenotipo no está escrito en el genoma, debe ser construido a partir de una compleja interacción. Esto es importante en la comprensión de los trastornos mendelianos (Pigliucci, 2010). Las llamadas puntuaciones de riesgo poligénico (PRS) de las enfermedades complejas se relacionan con el fenotipo de forma estadística y bayesiana, por lo que la predicción es inherentemente probabilística sujeta a errores y sesgos, por lo que deben integrarse siempre con otros datos para su adecuada interpretación.
El desarrollo de la transcriptómica, proteómica y metabolómica ha generado datos masivos que capturan estados intermedios entre el genotipo y el fenotipo (Williams-Blangero, 2004). Epistemológicamente, esto nos obliga a definir distintos niveles de lo fenotípico (molecular, celular, del organismo), sin que haya un salto directo del gen al rasgo visible. Así, ha surgido el concepto de endotipo, en el que estos fenotipos moleculares o celulares pueden ser indicativos de la fisiopatología específica de algunas patologías clínicamente similares (como enfermedades inmunológicas), pero heterogéneas en su mecanismo (Thompson et al., 2025). Esta información puede ser crítica para la aplicación de tratamientos personalizados.
Manejo de los datos masivos en la era postgenómica
La creciente complejidad causal, probabilística y sistémica de la relación genotipo-fenotipo, hace necesario que el conocimiento genético se base en una cantidad ingente de datos (big data), que no está al alcance del simple razonamiento humano. Por un lado, están las variantes muy numerosas en el ADN respecto al genoma de referencia descubiertas por la NGS, entre las cuales algunas pueden ser patogénicas y, por su importancia funcional, contribuir a enfermedades monogénicas. Otras sólo causan patología cuando se combinan en cierto número (en ocasiones, cientos o miles), cada una de ellas con un efecto individual minúsculo, lo que requiere para su demostración estadística el análisis de grandes poblaciones en los estudios de asociación pangenómica (GWAS) (Moore, Asselbergs y Williams, 2010).
Incluso en las enfermedades monogénicas, como ya se ha dicho, el modelo causal es probabilístico y, para poder refinar las predicciones y diagnósticos, cada vez va a ser más importante disponer, además de los datos genómicos, de los aportados por la epigenómica, transcriptómica, la proteómica, la metabolómica o incluso la influencia específica del ambiente (exposoma) (Scriver y Waters, 1999). La integración de todas estas capas de información exige una capacidad de almacenamiento y computación masiva. Esta estrategia de análisis puede modificar el planteamiento actual (verificar el efecto hipotético de genes determinados a priori) e identificar patrones emergentes que sugieran nuevas hipótesis sobre la arquitectura de los sistemas biológicos.
Además del almacenamiento y computación mencionados, el análisis de datos masivos plantea múltiples retos tecnológicos: requiere la utilización de formatos estandarizados, bases de datos integradas, análisis estadísticos avanzados, sistemas de verificación y reproducibilidad y el desarrollo de algoritmos, en los que van a ser imprescindibles los sistemas de aprendizaje automático y la inteligencia artificial. Sin embargo, siempre existe el riesgo de encontrar únicamente correlaciones, que no son una prueba absoluta de causalidad, y la dificultad de distinguir la información válida de simple ruido. Por ello, en la interpretación correcta de los big data es necesario tener un marco teórico robusto sobre la biología de sistemas, el desarrollo y la evolución, que maticen la verdadera relevancia de los hallazgos.
Criterios de normalidad y patogenicidad
Las guías del American College of Medical Genetics and Genomics (ACMG) para la clasificación de variantes genéticas en categorías no se basan en una prueba definitiva, sino en un sistema de evidencia acumulativa, donde criterios de muy distinta naturaleza (poblacionales, funcionales, computacionales, segregación familiar) se ponderan para llegar a una clasificación probabilística. En realidad, se trata de un sistema de interpretación causal bajo incertidumbre, que muestra las dificultades de inferir conocimiento biológico a partir de datos masivos (Sinnott-Armstrong et al., 2024).
En primer lugar, la frecuencia alta de un alelo en una población sana es un fuerte indicador de benignidad, lo que parece deducirse del principio de selección natural. Obviamente, este criterio es dependiente de la población de referencia considerada (mayoritariamente con individuos de ancestros europeos) con sus potenciales sesgos. La evidencia computacional (algoritmos de predicción in silico) son modelos entrenados también con datos conocidos, lo que supone un riesgo de circularidad y fallo ante variantes raras o en contextos no previstos durante su entrenamiento. El estándar de oro para la clasificación sería el ensayo funcional; sin embargo, también en éste podría haber la posibilidad de error, ya que un ensayo en cultivo celular (in vitro) no siempre captura la complejidad del organismo completo (in vivo).
Con estas premisas, no sorprende la proporción elevada de variantes clasificadas de significado incierto (VUS), sobre todo en los genes menos estudiados. Esta categoría, que contrasta con la expectativa clínica y del paciente de una respuesta binaria (sano/enfermo), es una declaración provisional de ignorancia, sujeta a reclasificación constante a medida que se acumulan nuevas evidencias (Burke et al., 2022). Plataformas como ClinVar, donde laboratorios y clínicos comparten sus interpretaciones (a menudo en conflicto), suponen un modelo epistemológico distribuido y consensuado, donde la verdad se negocia y se aproxima de forma colectiva.
Utilidad y riesgos de las metáforas en Genética
En el marco de la complejidad descrita, de algunas metáforas de uso común en Genética (código, programa, expresión génica, etc.) han sido herramientas cognitivas indispensables para comunicar ideas con una gran utilidad pedagógica, clínica y para orientar la investigación (Rosner y Johnson, 1995). El malentendido surge cuando se olvida que son metáforas y se tratan como descripciones literales de la realidad. Esto conduce a distorsiones conceptuales que perpetúan un mecanicismo reduccionista (Griffiths, 2001).
Como se ha dicho, lejos del determinismo genético, la realidad supone una interacción del genoma muy dinámica con otros sistemas biológicos y el ambiente. De esta forma, más que un anteproyecto (blueprint) o libro rígido de instrucciones, se ha propuesto la analogía del genoma con una partitura musical. La música emerge de la interpretación de la partitura por parte de los músicos (la maquinaria celular), bajo la dirección de un director (epigenética/ambiente) (Figura 2). La misma partitura puede sonar de manera muy diferente según sus intérpretes y el contexto.
Glosario de términos de Filosofía de la Ciencia aplicables en Genética
Abducción. Forma de razonamiento que propone la mejor explicación posible para un fenómeno.
Bioética. Disciplina que estudia la conducta humana en el ámbito de las ciencias de la vida y de la salud, examinada a la luz de valores y principios morales.
Criterio de demarcación. Norma que distingue lo científico de lo no científico.
Deducción. Tipo de razonamiento en el que la conclusión se sigue de manera necesaria de las premisas.
Determinismo. Tesis que sostiene que todos los acontecimientos están causalmente fijados, sin considerar otras influencias variables.
Emergentismo. Idea, opuesta al reduccionismo, de que los sistemas pueden tener propiedades (emergentes) que no pueden ser completamente explicadas o predichas solo a partir del conocimiento de sus componentes individuales, sino que surgen de sus interacciones complejas.
Empirismo. Doctrina que sostiene que la experiencia es la base del conocimiento.
Epistemología. Estudio de la naturaleza y los límites del conocimiento, qué se considera evidencia válida, cómo se confirman o refutan las teorías y qué tipos de explicaciones son aceptables.
Escepticismo. Actitud que cuestiona la posibilidad o alcance del conocimiento.
Esencialismo. Idea de que los seres poseen propiedades fijas e inmutables.
Explicación funcional. Interpretación de un fenómeno en términos de su función o finalidad.
Explicación mecanicista. Descripción basada en la interacción estructurada de partes y sus consecuencias en los procesos.
Falsación. Criterio que establece que una teoría debe poder ser refutada.
Hermenéutica. Método interpretativo aplicado a textos y significados.
Heurística. Estrategia que guía la búsqueda de soluciones aproximadas.
Idealismo. Doctrina que atribuye primacía ontológica a las ideas.
Inducción. Proceso mediante el cual se generaliza a partir de casos particulares.
Inferencia. Proceso mediante el cual se extrae una conclusión a partir de premisas.
Mereología. Estudio de las relaciones entre partes, tanto de las partes con el todo, como de las partes con otras partes.
Ontología. Estudio de lo que existe y de su estructura fundamental.
Pluralismo explicativo. La idea de que los fenómenos pueden requerir múltiples tipos de explicaciones (por ejemplo, causales, funcionales, mecanicistas) que operan en diferentes niveles de organización y que no se pueden reducir a una única explicación.
Positivismo. Corriente que limita el conocimiento válido a lo verificable empíricamente.
Probabilismo. Reconocimiento del papel estructural de la probabilidad en el conocimiento.
Racionalismo. Doctrina que confiere primacía a la razón como fuente de conocimiento.
Realismo científico. Doctrina que afirma que las teorías bien confirmadas describen la realidad.
Reduccionismo. Explicación de fenómenos complejos en términos de sus elementos básicos.
Singularidad. Estado o fenómeno que no se ajusta a reglas habituales.
Teleología. Explicación basada en fines o propósitos.
Verificacionismo. Tesis según la cual solo son significativas las proposiciones verificables.
BIOÉTICA Y GENÉTICA
Autonomía y consentimiento
La información genética se caracteriza por ser íntima, predictiva, compartida y permanente. Esta naturaleza peculiar hace que la obtención del consentimiento informado para poder realizar una prueba genética no sea un mero trámite, sino una expresión fundamental e imprescindible del principio bioético de autonomía y del respeto a la dignidad humana. La persona debe comprender todas las implicaciones del posible resultado antes de decidir si quiere saber. A menudo, las pruebas genéticas pueden identificar una predisposición para la cual no existe una terapia preventiva o curativa efectiva. Un consentimiento verdaderamente informado debe incluir la opción de rechazar la prueba (derecho a no saber) o elegir qué tipos de resultados se desean conocer (por ejemplo, algunos deciden no recibir hallazgos incidentales no relacionados con el motivo principal del estudio) (Pampols et al., 2013).
En este sentido, el asesoramiento genético constituye no un mero complemento, sino la condición de posibilidad para un proceso de consentimiento verdaderamente informado y una autonomía real. Además de proporcionar una información precisa sobre la sospecha diagnóstica, su evolución y las opciones preventivas, terapéuticas y reproductivas, debe establecer una comunicación efectiva y no directiva con la persona y proporcionar el adecuado soporte emocional y psicológico para que elija libremente, según sus propios valores. Por otra parte, el asesoramiento es un proceso longitudinal y prolongado en el tiempo, ya que se mantiene en el momento de comunicar los resultados y durante el acompañamiento para hacer efectivas las opciones mencionadas. El consentimiento informado, desprovisto de un asesoramiento genético real, completo y empático, se reduce a un formulario lleno de tecnicismos que se firma desde la desinformación y la asimetría de poder.
Privacidad y discriminación
Dentro del derecho a la privacidad y a la protección de los datos personales, que está ampliamente consolidado y regulado en los países occidentales sobre todo en Europa, existe un debate no resuelto sobre el llamado excepcionalismo genético. Los defensores de éste argumentan que la información genética de los individuos debería gozar de una protección especial, frente a otros datos de salud y personales, debido a sus especiales características antes comentadas (permanencia, predictividad, compartida con familiares), además de por su complejidad interpretativa. Así, el riesgo de que sean la base para la estigmatización personal y familiar y para la discriminación laboral o socioeconómica es elevada. Esto ha motivado la promulgación de algunas normas específicas, como la Genetic Information Nondiscrimination Act (GINA) de EEUU en 2008. Sin embargo, se está imponiendo el criterio de que los datos genéticos deben tener un nivel de protección muy alto, pero similar a otros datos sensibles de salud y personales, que también podrían causar estigma y discriminación (Kakuk, 2006). Esta es la perspectiva del Reglamento General Europeo de Protección de Datos Personales de la UE de 2016.
Por otra parte, aunque no es frecuente, puede surgir un conflicto de intereses cuando una persona portadora de una alteración genética, que conllevaría también un riesgo grave y prevenible para otros miembros de la familia, se niega persistente y explícitamente a informar a los familiares de esta posibilidad. Aquí colisionan los principios de autonomía y el derecho a la privacidad de la persona con el de beneficencia y no maleficencia para sus familiares. Si éstos no son informados, se les priva de la oportunidad de realizar un seguimiento y vigilancia adecuados con pruebas diagnósticas tempranas o medidas de prevención que podrían tener efectos importantes en sus vidas. En estos casos el marco legal no es determinante y la solución al conflicto se presta a distintas interpretaciones y jurisprudencia. Por ello, es fundamental la tarea del profesional que proporciona el asesoramiento genético para persuadir y empoderar al paciente en la tarea de comunicar y proteger la salud de sus familiares.
Equidad y representatividad
El principio bioético de justicia está también comprometido muy a menudo en la prestación de atención genética por los servicios de salud. En primer lugar, la escasez y concentración de los recursos de Genética Médica crean las condiciones para una inequidad grave en su provisión para los individuos en función de factores geográficos o socioeconómicos. Esta brecha es más profunda en países como el nuestro sin especialidad sanitaria reconocida y sin un desarrollo organizado, cuyas soluciones locales están basadas en el voluntarismo u otras circunstancias o peculiaridades. De esta manera, solo una élite con recursos y educación o con una ubicación geográfica privilegiada puede beneficiarse de los avances en este campo.
Otro problema más sutil, pero igual de profundo e injusto, es el sesgo étnico y poblacional en la investigación genética. Las bases de datos de referencia, que se utilizan para determinar si una variante genética es patogénica o benigna, y la gran mayoría de los estudios de asociación genómica (GWAS) se han construido principalmente con datos de poblaciones de ascendencia europea mayoritariamente blancas. Así, cuando se secuencia el ADN de un individuo de una ascendencia subrepresentada (africana, latinoamericana o algunas asiáticas) es mucho más probable que se encuentren variantes de significado incierto, que limitan la toma correcta de decisiones. Este sesgo también implica que los beneficios de la medicina de precisión están siendo calibrados para un solo un sector de la población.
Genética reproductiva
Un aspecto presente de forma habitual durante el asesoramiento genético es el riesgo de transmisión a la descendencia de la alteración genética que se esté considerando. A la vez, se suelen plantear, según la gravedad de esta alteración, las posibilidades de evitar esta transmisión (Korngiebel et al., 2016). En estos casos se producen tensiones y conflictos que pueden ser éticos, morales, religiosos o legales. La propia decisión de prevenir la transmisión depende de la gravedad del trastorno, tanto por su pronóstico y opciones terapéuticas más o menos efectivas, como por la percepción de gravedad que ha supuesto la enfermedad en el individuo o su familia.
La misma patología puede tener un impacto muy variable y con frecuencia es difícil hacer estimaciones objetivas o externas de este punto. Por ello, los profesionales no deben realizar asunciones a priori y deben esforzarse en comprender la perspectiva de los pacientes.
Una de las opciones en las parejas que quieren tener hijos biológicos sin una anomalía hereditaria conocida es el diagnóstico prenatal (DPN) (Stapleton, 2017; Nakou, 2021; Zaami et al., 2021) mediante biopsia corial o amniocentesis, para decidir, en el caso de que el embrión o el feto estuviera afectado, la interrupción legal del embarazo (ILE). En España esta opción está regulada en la Ley Orgánica 2/2010 de salud sexual y reproductiva y de la interrupción voluntaria del embarazo, que define unos plazos: hasta la semana 14+1 no hay que invocar un motivo específico para la ILE (aunque este motivo puede ser el conocimiento temprano de que el feto esté afectado), hasta la semana 22 si existe riesgo para la salud o la vida de la embarazada o si el feto presenta anomalías graves, incluidas las genéticas (ya se ha comentado la dificultad de definir la gravedad de forma objetiva), y después de la semana 22+1 si se detecta una anomalía fetal extremadamente grave e incurable o incompatible con la vida. Mientras que en la primera situación la decisión de ILE es un ejercicio de la autonomía de la embarazada, en los dos últimos casos la gravedad debe ser confirmada, al menos, por dos médicos o un comité.
La otra opción para tener descendencia biológica libre de una alteración genética conocida en los progenitores es el diagnóstico preimplantacional (DGP) tras una fecundación in vitro (Krahn, 2007). Se trata de analizar genéticamente los pre-embriones y seleccionar aquellos que no portan la alteración genética específica antes de su transferencia al útero. En este caso el marco legal español está contenido en la Ley 14/2006 sobre técnicas de reproducción humana asistida.
El DGP está permitido para la detección de enfermedades genéticas graves, de aparición precoz y no susceptibles de tratamiento curativo posnatal con los conocimientos actuales, u otras alteraciones que puedan comprometer la viabilidad del embrión. También está permitido para la selección de un pre-embrión que sea histocompatible con un hermano enfermo y que un trasplante de células de su cordón umbilical pueda curarle. En ningún caso está permitido para para elegir características no patológicas (incluido el sexo sin vinculación a una enfermedad).
Los dos procedimientos referidos (DPN y DGP) están inmersos en complejos conflictos morales y psicológicos para los progenitores y éticos para el sistema y la sociedad. Los progenitores se debaten entre el deseo de reproducirse y el de no causar sufrimiento a una futura descendencia, mezclados con los sentimientos de culpa por la eventual decisión de ILE o la excesiva medicalización y complejidad del DGP.
Para la sociedad los conflictos surgen por la estigmatización de cualquier forma de discapacidad (Deem, 2016; Gastaldi, 2020), que en su extremo podría interpretarse como una forma de eugenesia blanda o liberal, y por la limitación del principio de justicia, cuando estas técnicas no están accesibles de una forma equitativa para la población o solo cuando se dispone de los recursos económicos para realizarlas en el ámbito privado. También se producen contradicciones morales cuando algunos aceptan sin problemas el DGP, pero consideran inaceptable la ILE, olvidando el destino de los pre-embriones no implantados.
Siempre hay que recordar que existen otras opciones reproductivas, como la utilización de gametos de donante o la adopción. Aquí también la calidad del asesoramiento genético es la clave para manejar esta complejidad con respeto y sin imposiciones.
Manipulación del genoma y edición génica
No todo lo que se puede hacer se debe hacer. La posibilidad actual de editar el genoma con herramientas como CRISPR-Cas9 supone la frontera más avanzada y con mayor complejidad ética de la Genética Médica actual (Salas, 2022; Alonso Fernández, 2023). Hay dos ámbitos críticos con diferentes conflictos. El primero es el alcance de la intervención: si el objeto de la edición es la línea germinal (por lo tanto, con cambios heredables) (Wiley et al., 2025) o las células somáticas. El segundo se refiere a la intencionalidad terapéutica o correctora de una patología.
Cuando la intención es curativa y se actúa sobre células somáticas no se plantean conflictos éticos, más allá del comentado principio de justicia y garantizar la equidad, algo en sí mismo ya problemático. Cuando se trata de mejorar las características individuales resultaría inaceptable porque se crearía una brecha profunda entre los pocos individuos mejorados genéticamente y el resto. Todo ello teniendo en cuenta que hay que investigar en profundidad estos procedimientos para evitar efectos indeseables desconocidos, tanto on-target (lugar correcto, pero con consecuencias imprevisibles debidas a los mecanismos celulares de reparación del ADN) como off-target (efectos secundarios por alterar otras secuencias del genoma similares a las del objetivo) (Rueda et al., 2025). Además, se produciría una tendencia indeseable a reducir la diversidad genética.
Actualmente hay un amplio consenso de que no es ético la edición de la línea germinal, de acuerdo con declaraciones de la OMS, la UNESCO y el Convenio de Oviedo del Consejo de Europa. En nuestro país está expresamente prohibido por Ley 14/2007 de investigación biomédica.
En resumen, las expectativas para resolver anomalías genéticas con la edición génica son razonables y enormes; pero se debe imponer el principio de prudencia para su implantación y realizar antes investigaciones rigurosas con todas las garantías éticas y legales. Siempre con la idea de no caer por una pendiente deslizante y peligrosa hacia una distopía eugenésica.
Determinismo genético vs. responsabilidad individual
Se ha avanzado mucho en las bases genéticas de la personalidad y la conducta, lo que supone una limitación al concepto clásico del libre albedrío humano. Sin embargo, la relación entre genes y conducta no es lineal ni determinista, sino probabilística y contextual. La arquitectura genética no es una condición inexorable, sino una predisposición o una vulnerabilidad, que interactúa de forma compleja con el ambiente, las experiencias vitales, las elecciones personales y la cultura.
Este planteamiento tiene consecuencias filosóficas, éticas y legales.
El cerebro humano es un órgano con una elevada plasticidad, por lo que las experiencias, el aprendizaje y la reflexión pueden modificar físicamente la estructura y función del cerebro. Esto sugiere que, incluso con ciertas predisposiciones, tenemos la capacidad de ejercer un control cognitivo superior, de modular nuestros impulsos y de tomar decisiones conscientes que vayan en contra de una tendencia innata. Por ello, la genética no anula el concepto de responsabilidad, pero podría influir en su evaluación, especialmente en la imputabilidad (capacidad de comprender la ilicitud del acto y de actuar conforme a esa comprensión).
En muchos ordenamientos jurídicos, como el español, una alteración psíquica puede ser considerada una circunstancia atenuante. Una abrumadora predisposición genética, combinada con un ambiente desencadenante (Santaló y Berdasco, 2022), podría, en casos extremos y documentados, ser esgrimida como prueba de una alteración que disminuyó la capacidad de autocontrol del individuo y ser considerada un atenuante penal.
La otra cara de la moneda de una visión determinista ha sido la justificación del nefasto darwinismo social, según el cual la riqueza y el poder son resultado de la superioridad biológica de los individuos y grupos, por lo que la intervención de los poderes públicos para corregir desigualdades sería innecesaria o perjudicial.
Genética y mercado
El modelo de negocio globalizado y digital ha democratizado el acceso a la información genética (pruebas directas al consumidor), pero al coste de convertirla en una mercancía, con todos los riesgos que ello conlleva. En ocasiones se requiere la autorización de un médico sin conocimientos de genética, como un simple trámite formal (Kilbride y Bradbury, 2025).
Las empresas ofrecen un producto atractivo de autoconocimiento (tanto del riesgo de desarrollar enfermedades como del origen de sus ancestros) que apela al principio de autonomía. Sin embargo, el consumidor a menudo no es plenamente consciente de lo que está comprando, de la complejidad de la interpretación o del uso que se hará de sus datos. El marketing puede exagerar los beneficios o la certeza de los resultados, creando expectativas poco realistas.
Aunque suele existir un formulario de consentimiento, éste suele ser un extenso acuerdo de términos y condiciones online que pocos leen en profundidad y carece de valor en cuanto a un asesoramiento genético real. Las empresas venden el kit y el informe, pero no se hacen cargo de las consecuencias médicas o emocionales, dejando al usuario abandonado y que sea el sistema público de salud quien solucione los problemas que se generan. Además, el sujeto puede estar cediendo derechos sobre sus datos genéticos de una forma que no comprende. Para evitar estos inconvenientes debería existir una regulación estricta sobre la publicidad, la calidad técnica de las pruebas, la privacidad de los datos y la obligación de proporcionar asesoramiento genético por profesionales acreditados.
Por otra parte, la posibilidad de patentar tecnologías genéticas (se llegaron a patentar las secuencias de genes) crea un conflicto fundamental entre el incentivo a la innovación y el acceso universal al conocimiento. Actualmente el consenso global es que no se pueden patentar genes humanos descubiertos en la naturaleza, pero sí desarrollos derivados, como pruebas diagnósticas específicas, métodos terapéuticos o tecnología de edición genética (que de hecho ha generado una enorme batalla de patentes) (Everett, 2003).
La información genética es demasiado poderosa, íntima y no exenta de efectos adversos para ser tratada como un producto comercial más. Su gestión debe estar guiada por unos criterios éticos que prioricen siempre el bienestar de las personas sobre el beneficio económico.
REFLEXIÓN FINAL
Los avances científicos en Genética son inseparables de profundas transformaciones conceptuales y conflictos éticos. La evolución de esta disciplina nos obliga a abandonar viejas certidumbres y a adoptar una visión más dinámica, compleja y matizada. Una perspectiva filosófica no es un mero adorno, sino una herramienta indispensable, que permite cuestionar los supuestos, clarificar los conceptos y evaluar las implicaciones de una de las ciencias más poderosas de nuestro tiempo. Integrar la Filosofía en el ámbito de la Genética es esencial para asegurar que su profundo impacto en la ciencia y la sociedad no solo sea innovador, sino también comprensivo, inteligente y responsable.
Declaración de conflicto de intereses
El autor declara no tener ningún conflicto de intereses respecto a la redacción de este artículo

