IMPACTO DE LAS BACTERIAS MULTIRRESISTENTES EN SALUD
El descubrimiento de los antibióticos supuso una revolución en medicina y ha ayudado a salvar millones de vidas. Sin embargo, su uso descontrolado ha favorecido la emergencia de bacterias resistentes. Los antibióticos actúan como presión selectiva de forma que favorecen el crecimiento de bacterias que han desarrollado mecanismos de resistencia a los mismos mediante mutaciones puntuales o la adquisición de elementos genéticos móviles (Baym et al., 2016; Oz et al., 2014; Reygaert, 2018; Wistrand-Yuen et al., 2018). Estas bacterias pueden adquirir resistencias a múltiples antibióticos y se denominan multirresistentes (MDR) o superbacterias. La propagación de estas bacterias MDR se ha convertido en una amenaza mundial, ocasionando graves pérdidas humanas y económicas (O’Neill, 2014; de Kraker et al., 2016). A día de hoy, la Organización Mundial de la Salud (OMS) considera ciertos grupos de bacterias MDR de alto riesgo, siendo algunas de ellas de prioridad crítica, debido a su alta propagación y a sus elevadas tasas de resistencia. Algunos ejemplos son Acinetobacter baumannii, Pseudomonas aeruginosa y varias enterobacterias como Klebsiella pneumoniae, Escherichia coli, Serratia sp. y Proteus sp. Para algunas de estas bacterias MDR no existen tratamientos eficaces, resultando en un problema global que requiere una solución rápida mediante el desarrollo de terapias alternativas. Desgraciadamente, un estudio reciente ha demostrado que estas superbacterias causaron la muerte de 1,2 millones de personas en el 2019 (Antimicrobial Resistance Collaborators, 2022). De hecho, se estima que si la tasa de emergencia de resistencias continúa creciendo como hasta ahora, en el año 2050 el número de muertes causadas por bacterias MDR será superior a la mortalidad asociada a cáncer (de Kraker et al., 2016). Estas cifras nos recuerdan a la pandemia causada por el coronavirus SARS-CoV-2, agente causal de la enfermedad asociada COVID-19, que ha puesto en jaque al mundo entero. En este caso, la rápida respuesta basada en la vacunación masiva ha sido gracias a la culminación de años de trabajo en investigación básica, reflejando el papel de la ciencia en la sociedad, y la necesidad de invertir en investigación, desarrollo e innovación (I+D+i).
La rápida expansión del coronavirus ha puesto también de manifiesto la importancia y el reto que supone combatir patógenos emergentes con anticipación, dado el desconocimiento existente sobre los mismos y sus posibles tratamientos. Si algo debemos aprender de esto, es la necesidad de estar preparados para futuras pandemias, siendo capaces de detectar y tratar enfermedades causadas por patógenos emergentes o reemergentes (Alsaadi et al., 2021). Aunque las infecciones virales, sobre todo las causadas por virus respiratorios de transmisión aérea, son capaces de expandirse rápidamente y difíciles de contener, algunas infecciones bacterianas también presentan una elevada incidencia y son responsables de altas tasas de mortalidad a nivel mundial (O’Neill et al., 2014). Desafortunadamente, la crisis sanitaria actual de la COVID-19 empeora las perspectivas, ya que se ha visto que las infecciones bacterianas secundarias y el abuso de los antimicrobianos para evitarlas está favoreciendo la emergencia de bacterias MDR y su expansión global (Morens et al., 2008; Morris et al., 2017; Smith y McCullers, 2014), dando lugar a la que se conoce como la “pandemia silenciosa” de las superbacterias. Se estima que alrededor del 50% de los fallecimientos de pacientes con COVID-19 en unidades de cuidados intensivos fueron debidos a infecciones bacterianas secundarias (Zhou et al., 2020). De hecho, se observó una correlación entre el aumento de la tasa de mortalidad y la duración del periodo de hospitalización debido a las superbacterias (Feng et al., 2020). Sin embargo, ciertas medidas de control del SARS-CoV-2 pueden tener un impacto positivo sobre el problema de las superbacterias, incluyendo recomendaciones de higiene personal, el uso de mascarillas, la distancia social y la desinfección de espacios. Asimismo, la disminución de viajes y la mayor concienciación sobre la salud pueden disminuir la dispersión de bacterias MDR a nivel global. Por otra parte, la pandemia ha llevado a un incremento de la automedicación con antibióticos por parte de la sociedad, así como al aumento de la prescripción de antibióticos para reducir infecciones secundarias, lo que contribuye a la propagación de bacterias MDR. Finalmente, cabe destacar que la pandemia también ha disminuido significativamente tanto la vigilancia de las superbacterias en los hospitales como la investigación sobre las mismas, contribuyendo a la problemática y dificultando su control (Rodríguez-Baño et al., 2021).
Por otra parte, dado el creciente impacto de enfermedades zoonóticas en la salud púbica, es de especial interés conocer las vías de transmisión entre humanos y animales. Es por ello que la aproximación “One Health”, la cual pretende unificar la salud humana, animal y ambiental en un programa único, indica que se requiere de un esfuerzo multidisciplinar para luchar contra bacterias MDR entre otras enfermedades. El objetivo de esta aproximación es una mejor comprensión de la ecología de infecciones zoonóticas y una detección más rápida de brotes causados por las mismas para poder desarrollar planes de respuesta y control (Mackenzie y Jeggo, 2019). En este sentido, el uso abusivo de antibióticos también se extiende a su aplicación en granjas, en las cuales se utilizan en prevención de enfermedades y como compuestos promotores de crecimiento (Van Boeckel et al., 2015). Esto contribuye a la dispersión de bacterias MDR mediante el consumo de animales y del vertido de desechos procedentes de la ganadería, que a través de la cadena alimenticia pueden alcanzar a los humanos, además de suponer elevadas pérdidas económicas (Ferriol-González y Domingo-Calap, 2021). Lo mismo ocurre en agricultura, donde la incidencia de bacterias fitopatógenas resistentes es muy elevada, y se han descrito bacterias MDR. También suponen un problema en la industria agroalimentaria, ya que los tratamientos de desinfección son en ocasiones poco eficientes. Las bacterias MDR afectan a diversas secciones incluyendo materias primas, líneas de producción y producto final, suponiendo un fuerte impacto económico y en la salud de los consumidores (Bridier et al., 2015). La transferencia horizontal de genes o plásmidos de resistencia entre bacterias presentes en los diferentes ecosistemas hace, por tanto, que se propaguen cepas resistentes en diversos ambientes, dificultando en última instancia el tratamiento de bacterias patógenas de interés, y contribuyendo a que las bacterias MDR se impongan a nivel global.
EL DESCUBRIMIENTO DE LOS FAGOS COMO HERRAMIENTAS TERAPÉUTICAS ANTIBACTERIANAS
Debido a la ineficacia de los tratamientos actuales, la lucha contra bacterias MDR requiere el desarrollo de nuevas terapias. Una de las alternativas más prometedoras es el uso de los bacteriófagos, virus de bacterias, como herramientas biomédicas. Los bacteriófagos, también conocidos comúnmente como fagos, presentan una variabilidad enorme. Pueden encontrarse en prácticamente cualquier entorno, presentando ciclos biológicos variables, siendo los más comunes el ciclo lisogénico y el lítico. En el primero, el genoma del virus se inserta en el genoma bacteriano y se divide junto con la célula hospedadora. En el ciclo lítico, el virus replica utilizando la maquinaria de la bacteria hospedadora y provoca la lisis celular para liberar los nuevos viriones, siendo este último el de mayor interés como herramienta terapéutica (Domingo-Calap et al., 2016).
Los fagos fueron descubiertos de manera independiente por Frederick Twort y Félix d’Hérelle. En 1915, analizando cultivos de Staphylococcus sp., Twort observó regiones libres de cultivo en forma de halos causadas por lo que él denominó “agente bacteriolítico” (Twort, 1930, 1915). Casi simultáneamente, fue d’Hérelle quien acuñó el nombre de bacteriófagos tras examinar el mismo efecto sobre Salmonella gallinarum en heces de gallina. Además, d’Hérelle fue el primero en aplicar los fagos en pacientes, tratando niños con disentería en Francia y cólera en India de manera exitosa (d’Herelle, 1936; D’Herelle, 2007). Sin embargo, pocos años después, debido al descubrimiento de los antibióticos (de amplio espectro), así como a la publicación de revisiones críticas contra la terapia con fagos (Eaton y Stanhope, 1934; Krueger y Scribner, 1941) y tras la II Guerra Mundial, el uso terapéutico de los fagos quedó relegado a los países del Este. A causa de la guerra, estos países no tuvieron acceso a los antibióticos, por lo que continuaron utilizando la terapia de fagos de forma rutinaria en clínica. En algunos de estos países, como Georgia y Polonia, los fagos se siguen usando desde entonces como tratamiento contra enfermedades bacterianas, y son sede de centros de investigación en fagos reconocidos mundialmente (Abedon et al., 2011).
Hoy en día, debido a la emergencia de bacterias MDR con ausencia de tratamiento disponible, la terapia de fagos ha resurgido en el mundo occidental. La necesidad de desarrollar alternativas a los antibióticos ha puesto en el punto de mira a los fagos, aunque la falta de regulación en los países occidentales hace que su uso esté restringido a casos concretos como terapia compasiva (Alsaadi et al., 2021). Cabe destacar que la FDA (Administración de Medicamentos y Alimentos) ha autorizado recientemente el uso de fagos en pacientes COVID-19 en unidades de cuidados intensivos en EEUU, debido a las altas tasas de mortalidad asociadas a infecciones secundarias producidas por bacterias nosocomiales en este tipo de pacientes (Adaptive Phage Therapeutics, Inc., 2021). Los resultados obtenidos en pacientes hasta la fecha son muy prometedores, abriendo la puerta a su uso en clínica. Sin embargo, es importante señalar que en la mayoría de estudios realizados hasta la fecha, los pacientes sometidos a terapia fágica han continuado su tratamiento con antibióticos, siendo en ocasiones difícil discernir entre el efecto único de los fagos o de su combinación con el antibiótico administrado (Abedon et al., 2021).
El uso de fagos presenta múltiples ventajas frente a los antibióticos, lo que los convierte en una potente alternativa (Tabla 1). Una de sus principales características es su elevada especificidad. Cada fago es capaz de reconocer una cepa hospedadora concreta, que presente los receptores específicos para ese fago. Los antibióticos, por el contrario, son muy generalistas y suelen afectar no solo a la cepa patógena, si no también a otras bacterias, incluyendo bacterias que forman parte de la microbiota beneficiosa dando lugar a complicaciones secundarias (Payne et al., 2000). Por otro lado, la elevada especificidad se puede ver como una desventaja dado que muchas enfermedades vienen causadas por más de una cepa bacteriana. Sin embargo, es posible ampliar el rango de acción mediante la elaboración de “cócteles de fagos”, es decir, preparaciones que contienen una combinación de fagos que pueden infectar cepas diferentes (Chan et al., 2013). También se pueden realizar experimentos de evolución dirigida para «entrenar» a los fagos y aumentar su rango de infección y/o capacidad lítica. Otra ventaja es la capacidad intrínseca de los fagos de replicar en el interior de sus hospedadores, multiplicándose en el lugar de la infección. La alta capacidad replicativa de los fagos hace que su producción sea relativamente sencilla y económica, ya que los fagos se aíslan del ambiente y su tiempo de producción es corto (Loc-Carrillo y Abedon, 2011; Makumi et al., 2021). Además, hoy en día se están realizando diversos estudios cuyo objetivo es optimizar el rendimiento de fagos a gran escala, lo que podría abaratar aún más si cabe su producción en comparación con los antibióticos (Krysiak-Baltyn et al., 2018; Silva et al., 2021).
Tabla 1. Comparativa entre fagos y antibióticos como tratamiento frente a infecciones bacterianas.
| Fagos | Antibióticos |
| – Específicos
– Replican en el sitio de infección – Producción económica – Capacidad de evolución y adaptación in situ – Gran polivalencia – Ausencia de legislación – Pocas publicaciones científicas y ensayos clínicos |
– Generalistas
– No replican – Elevado coste de producción – Moléculas estables – Baja polivalencia – Legislación actual detallada – Gran cantidad de publicaciones y ensayos clínicos validados |
En la naturaleza, los fagos y las bacterias conviven y coevolucionan. Si bien es verdad que las bacterias pueden generar mecanismos de resistencia a los fagos, los fagos son capaces de contrarrestar las resistencias, adaptándose a las nuevas condiciones y evolucionando para volver a ser capaces de infectar a la bacteria diana. Por este motivo, los fagos puede considerarse como “medicamentos adaptativos” (Green et al., 2017). En contra, los antibióticos son moléculas químicas estables, incapaces de responder a los sistemas de resistencia bacterianos. En general, los fagos presentan una gran polivalencia, pudiéndose utilizar para una amplia variedad de funciones, tanto solos como formando parte de cócteles, en combinación con antibióticos o haciendo uso de enzimas derivadas de los mismos (Domingo-Calap y Delgado-Martínez, 2018). A pesar de todas estas ventajas, la ausencia de legislación y de medidas regulatorias apropiadas para el uso de los fagos en los países occidentales limitan su aplicación en clínica.
Aplicaciones de los fagos en biomedicina
Las aplicaciones de los fagos en biomedicina son muy diversas. Aunque su uso más conocido sea terapéutico, los fagos también se han postulado como herramientas muy útiles en prevención y en diagnóstico (Domingo-Calap et al., 2016). En cualquier caso, los fagos pueden utilizarse tanto de forma individual como combinando varios de ellos formando cócteles. Esto permite aumentar el rango de infección, así como disminuir la probabilidad de que se generen resistencias si cada uno de ellos presenta un mecanismo de infección diferente (Chan et al., 2013; Melo et al., 2016). Otra posibilidad es su administración en combinación con antibióticos (Kim et al., 2018; Segall et al., 2019), el uso de enzimas derivadas de fagos (São-José, 2018), o incluso como mecanismo de interferencia con virus eucariotas (Górski et al., 2020).
Por otra parte, la gran versatilidad de los fagos hace que sean muy sencillos de manipular genéticamente. Esto abre la puerta a nuevas posibilidades a la hora de utilizar los fagos, y desarrollar nuevas aplicaciones de los mismos. Uno de los ejemplos que mejor ilustran la manipulación genética en fagos es el “phage display”. En 1985, George P. Smith (Smith, 1985) desarrolló esta técnica de edición genómica que permitió, mediante modificaciones genéticas, la expresión de péptidos exógenos asociadas a proteínas estructurales de cubierta de los fagos. A través de esta técnica, cuando los fagos replican se generan mutaciones al azar y se obtienen librerías de proteínas de secuencias aleatorias, permitiendo maximizar la afinidad y especificidad de la proteína de interés por una diana determinada. Gracias a estas librerías es posible llevar a cabo cribados hasta elegir los péptidos más apropiados para la diana en cuestión (Christensen et al., 2001; Pande et al., 2010). Esta técnica permite optimizar la terapia con fagos permitiendo la expresión de péptidos deseados en su cubierta, y dando lugar a un sistema con un sinfín de aplicaciones. Una de las más estudiadas son las librerías de anticuerpos monoclonales frente a determinadas bacterias y virus, ya que múltiples anticuerpos humanos para uso terapéutico se han desarrollado mediante “phage display” (Fernandez-García et al., 2020).
Los fagos pueden ser modificados genéticamente, lo que les confiere múltiples ventajas como promover la actividad lítica o modificar la diana de un fago, o crear fagos sintéticos capaces de reconocer células eucariotas, como por ejemplo células cancerígenas (Domingo-Calap y Delgado-Martínez, 2018; Hauser et al., 2016). Si modificamos enzimas implicadas en reconocimiento, podemos favorecer la entrada en células de forma dirigida, haciendo un uso de los fagos como vehículos de terapia génica. Mediante edición genética también se puede modificar o maximizar la afinidad y especificidad de un fago por un hospedador, o reducir la posible emergencia de resistencias bacterianas frente a los mismos (Christensen et al., 2001; Domingo-Calap y Delgado-Martínez, 2018; Ebrahimizadeh y Rajabibazl, 2014; Pande et al., 2010). El “phage display” también tiene otras utilidades en biomedicina como la creación de vacunas basadas en fagos, el estudio de interacciones proteína-proteína, o el desarrollo de nuevos antivirales (Ebrahimizadeh y Rajabibazl, 2014). De hecho, el desarrollo de productos basados en fagos está creciendo exponencialmente. Sin embargo, en esta revisión, vamos a centrarnos en las aplicaciones de los fagos en la lucha contra bacterias MDR.
Los fagos en prevención
Los fagos pueden usarse para prevenir infecciones bacterianas, ya que pueden servir como agentes desinfectantes. Dependiendo de la estabilidad del fago en condiciones variables, algunos fagos se pueden utilizar para tratar superficies y evitar contaminaciones bacterianas (Łusiak-Szelachowska et al., 2020). También pueden usarse como tratamiento profiláctico, para evitar infecciones bacterianas de interés (Chang et al., 2018). Aunque este campo de aplicación de los fagos como tratamiento preventivo todavía está bajo estudio, una de las opciones que más se está investigando es el uso de preparaciones de fagos inhalables para prevenir infecciones respiratorias. Un ejemplo concreto de este tipo de tratamiento profiláctico es el aerosol intranasal constituido por el fago P3-CHA para prevenir neumonías causadas por P. aeruginosa (Harada et al., 2018; Morello et al., 2011). A pesar de obtener resultados positivos en diversos trabajos in vitro, sigue siendo necesario determinar la cinética de los fagos en modelos animales, ya que se requiere conocer la tasa de eliminación de los fagos para poder diseñar estrategias de prevención adecuadas (Chang et al., 2018). Además, la estabilidad de los fagos es importante en el caso del uso de fagos para el tratamiento de superficies, o como tratamiento oral al tener que mantenerse estable en pHs extremos del estómago. En este caso, la nano- o microencapsulación de los fagos mejoraría su estabilidad y permitiría controlar su liberación, dando lugar a una mejora de los productos para su uso en biomedicina (Malik et al., 2017).
Muchos productos basados en fagos tienen como objetivo prevenir infecciones bacterianas que forman biopelículas (biofilms). Las biopelículas son agrupaciones bacterianas que pueden constar de una o varias especies y se caracterizan por estar embebidas en una sustancia extracelular polimérica producida por las propias bacterias que la forman. Las biopelículas se encuentran adheridas a superficies variables, tanto tejido vivo, como superficies inertes, incluyendo instrumental médico, alimentos, maquinaria industrial, o cañerías, entre otras (Ferriol-González y Domingo-Calap, 2020). Combatir biopelículas es de especial importancia en entornos hospitalarios, fuente de bacterias nosocomiales que generan complicaciones principalmente en pacientes inmunocomprometidos. Debido a la falta de acción de los antimicrobianos actuales, la aplicación de fagos solos o en combinación con otras medidas desinfectantes podría reducir la aparición de biopelículas. Un ejemplo de uso preventivo frente a biopelículas es el fago EFDG1, el cual ha sido testado frente a Enterococcus faecalis en un modelo de canal radicular en diente. El tratamiento con fagos redujo la proliferación bacteriana de manera muy significativa, protegiendo a los conductos radiculares dentales de infecciones por E. faecalis (Khalifa et al., 2015). Las biopelículas también se forman recurrentemente en dispositivos médicos como catéteres o prótesis provocando infecciones. Una de las bacterias que causa este tipo de biopelículas es P. aerunignosa. En un estudio reciente se ha testado un cóctel de cinco fagos usando un modelo in vitro. Se utilizaron catéteres que fueron tratados con el cóctel en cuestión sobre los cuales se estableció la biopelícula bacteriana. Los catéteres pretratados con el cóctel de fagos mostraron una reducción de la densidad bacteriana en la biopelícula del 99,9% (Fu et al., 2010). También se han testado cócteles de fagos como tratamiento preventivo frente a biopelículas de P. aeruginosa en tubos endotraqueales para su uso en intubación de pacientes con neumonía asociada a ventilación mecánica, observándose en los tubos pretratados una disminución de bacterias en el biofilm, sugiriendo el potencial de esta estrategia de control (Oliveira et al., 2021).
Otro ejemplo del uso preventivo de los fagos es su aplicación para el desarrollo de vacunas. Esto es posible gracias a la técnica de “phage display”, anteriormente mencionada. Mediante este método es posible desarrollar nuevos péptidos inmunogénicos para dar lugar a nuevas vacunas con mayor poder de inmunización. Esta técnica se está desarrollando para la prevención de enfermedades bacterianas (Bao et al., 2019), como por ejemplo la vacuna en desarrollo frente a pneumococos causantes de neumonía y meningitis, basada en exopolisacáridos de la cápsula bacteriana (Buchwald et al., 2005).
El uso de fagos en la industria alimentaria también puede tener función profiláctica. Múltiples infecciones bacterianas, incluidas algunas causadas por bacterias resistentes, son transmitidas a través de la alimentación. Para prevenir estas infecciones se han diseñado productos basados en fagos con el fin del eliminar estas bacterias de alimentos (Moye et al., 2018). Algunos de estos productos ya se están comercializando, como es el caso de PhageGuard ListexTM, una solución basada en fagos contra Listeria sp. (Oliveira et al., 2014; PhageGuard.com).
Los fagos en diagnóstico
Como hemos comentado previamente, los fagos tienen una gran especificidad por sus hospedadores, y podemos hacer uso de esta propiedad para desarrollar nuevas técnicas de diagnóstico y tipificación basadas en fagos. Hoy en día, sigue siendo muy laborioso tipificar bacterias o dar un diagnóstico adecuado en infecciones bacterianas, lo que hace que sea necesario desarrollar nuevas técnicas. Disponer de librerías de fagos capaces de reconocer bacterias de forma específica puede ser de gran relevancia a la hora de dar un tratamiento adecuado. Este tipo de técnica se puede basar en fagos completos o bien en el uso de proteínas derivadas de los mismos que estén implicadas en reconocimiento de la bacteria diana. En algunos casos, los fagos o las proteínas pueden modificarse genéticamente insertando genes indicadores, los cuales se detectan gracias a la conversión de un sustrato enzimático detectándose así la presencia de la bacteria hospedadora, y actuando como biosensores (Meile et al., 2020a). Se trata de un método muy sensible, existen distintos tipos en función de la reacción enzimática en la que se basa la detección. Un tipo de detección es la basada en bioluminiscencia, una reacción de oxidación llevada a cabo por enzimas llamadas luciferasas, en la cual se libera energía en forma de luz. Un ejemplo de esta técnica se llevó a cabo utilizando el myovirus A511 conteniendo la luciferasa Nluc, capaz de detectar Listeria monocytogenes en muestras de alimentos (Meile et al., 2020b). La detección también puede ser de tipo colorimétrico utilizando sustratos que se puedan detectar visualmente cuando son transformados en producto. Un ejemplo de este método utilizaba el fago T7 frente a E. coli con genes codificantes de fosfatasas (Jackson et al., 2016; Singh et al., 2019). También es posible la detección basada en electroquímica. Para ello, se utilizan biosensores electroquímicos que detectan especies electroactivas, que presentan algún tipo de actividad relacionada con su conformación o tamaño cuando son estimuladas por un campo eléctrico. La ventaja que presenta esta técnica es que en la detección no influye la turbidez o el color de la muestra (Meile et al., 2020a). El fago T7 también ha sido combinado con el operón LacZ, que produce β-galactosidasa, cuya hidrólisis genera un precipitado azul que permite su visualización (Wang et al., 2017). Por último, también es posible realizar la detección basándose en fluorescencia. En este caso, la mayoría de ensayos se han realizado frente a Mycobacterium sp., utilizando fluoromicobacteriófagos derivados del fago TM4 (Ford et al., 1998; Timme y Brennan, 1984; O’Donnell et al., 2019).
Los fagos como agentes terapéuticos
Terapia de fagos
Como se ha mencionado previamente, la terapia con fagos consiste en el uso de los mismos como tratamiento frente a infecciones bacterianas. Generalmente se requieren fagos líticos debido a que son capaces de destruir la bacteria hospedadora, a diferencia de los fagos atemperados que insertan su genoma en el genoma de la bacteria hospedadora y tienen menor actividad bactericida. De este modo, se evita la posible transferencia de genes de virulencia y resistencia (Criscuolo et al., 2017; Wittebole et al., 2014). Cabe destacar que la legislación actual todavía no permite la comercialización y aplicación de fagos en clínica en los países occidentales. Debido a esto, la gran mayoría de estudios realizados en esta área son in vitro o utilizando modelos animales (Fauconnier, 2019). Sin embargo, en algunos países se permite su uso como tratamiento compasivo. Se conoce como tratamiento compasivo al uso de medicinas que no se encuentran en ensayos clínicos en pacientes para los cuales no existe una opción terapéutica aprobada bajo la “Declaración de Principios Éticos para la Investigación en Medicina Relacionada con Humanos de Helsinki”. En los últimos años, la terapia con fagos se ha utilizado como tratamiento compasivo en más de 25 casos publicados (Alsaadi et al., 2021; McCallin et al., 2019; Schmidt, 2019). También se han usado fagos en medicina personalizada, formando parte de preparaciones magistrales en centros hospitalarios europeos (Pirnay et al., 2018).
Existen ejemplos muy interesantes que avalan el uso de fagos en clínica como tratamiento compasivo (Tabla 2). Uno de ellos fue el uso de un cóctel compuesto por tres fagos frente a Mycobacterium abscessus en una paciente con fibrosis quística sometida a doble trasplante de pulmón. El tratamiento se realizó vía intravenosa y la paciente mostró una buena tolerancia al mismo y una buena recuperación (Dedrick et al., 2019). Otro ejemplo es el caso de un paciente con pancreatitis necrótica complicada por una cepa de A. baumannii que infectó un pseudoquiste pancreático. Como tratamiento se aplicó una preparación intravenosa y percutánea de fagos con resultados de importante mejoría a los pocos días y total recuperación a largo plazo, aunque en este caso no se suspendió la administración los antibióticos con los que se estaba tratando al paciente previamente (Schooley et al., 2017). Otro caso es el de un paciente con prostatitis bacteriana crónica que había recibido tratamiento antibiótico en diversas ocasiones sin lograr mejoría a largo plazo. Las muestras de semen del paciente presentaban diversas especies de Staphyloccocus sp., E. faecalis y Streptococcus mitis. Se desarrolló una preparación de fagos que fue administrada tras remitir el tratamiento antibiótico. El tratamiento con fagos resultó tanto en una mejoría clínica como una reducción de la carga bacteriana, lo cual evidencia el potencial de los fagos tras el fracaso de antibióticos en infecciones con bacterias MDR (Johri et al., 2021). Estos ejemplos nos ayudan además a conocer el comportamiento de los fagos in vivo, pero están muy limitados debido a la falta de legislación, lo cual resalta la importancia de mejorar los marcos regulatorios de la terapia con fagos para poder implementarlos en clínica (Moelling et al., 2018).
Tabla 2. Ejemplos de ensayos de terapia con fagos con resultados positivos como tratamiento compasivo.
| Bacteria | Infección | Tratamiento | Tipo de estudio | Referencia |
| A. baumannii | Infección de pseudoquiste pancreático | Cóctel de fagos
No se remite el tratamiento antibiótico |
Caso clínico | (Schooley et al., 2017) |
| E. faecalis
Staphylococcus spp. P. aeruginosa |
Osteomielitis | Cóctel de fagos y antibiótico | Estudio con 4 pacientes | (Onsea et al., 2019) |
| E. faecalis, Staphylococcus spp.
S. mitis |
Prostatitis bacteriana crónica | Cóctel de fagos | Caso clínico | (Johri et al., 2021) |
| K. pneumoniae | Infección en prótesis de rodilla | Fago y antibiótico | Caso clínico | (Cano et al., 2021) |
| K. pneumoniae | Infección recurrente del tracto urinario en paciente trasplantado de riñón | Fago y antibiótico | Caso clínico | (Rostkowska et al., 2021) |
| K. pneumoniae | Víctima de terrorismo con infección en el muslo asociada a la cirujía. | Fago sometido a evolución dirigida y antibiótico | Caso clínico | (Eskenazi et al., 2022) |
| M. abscessus | Infección asociada a fibrosis quística | Cóctel de fagos | Caso clínico
|
(Dedrick et al., 2019) |
| P. aeruginosa | Biopelícula en prótesis vascular | Fago y antibiótico | Caso clínico
|
(Chan et al., 2018, 2016) |
| P. aeruginosa | Neumonía asociada a ventilación mecánica y epiema | Cóctel de fagos y antibiótico | Caso clínico | (Maddocks et al., 2019) |
| S. aureus | Bacteriemia | Cóctel de fagos y antibiótico | Ensayo clínico de un solo brazo no comparativo con 13 pacientes | (Petrovic Fabijan et al., 2020) |
| S. aureus | Infección recurrente de prótesis de rodilla | Cóctel de fagos y antibiótico | Estudio con 3 pacientes | (Ferry et al., 2020) |
| Staphylococcus sp. | Úlceras en pie | Fago | Conjunto de casos clínicos | (Fish et al., 2018) |
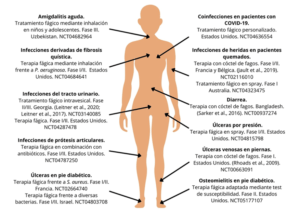
Sin embargo, en países del Este como Polonia o Georgia, la terapia de fagos se usa de forma rutinaria en clínica. A lo largo de la historia, en Polonia se han tratado miles de pacientes con fagos, generalmente en casos de infecciones crónicas. Actualmente, Polonia forma parte de la Unión Europea, por lo que la legislación al respecto ha cambiado (Abedon et al., 2011). Por otro lado, en Georgia, hay incluso cócteles de fagos comerciales disponibles sin prescripción médica como “Intestiphage” y “Pyophage” para el tratamiento de infecciones gastrointestinales y de heridas respectivamente (Kutter et al., 2010). En la actualidad, hay diversos ensayos clínicos de terapia fágica en marcha, junto con otros finalizados recientemente (Figura 1).
Enzimas derivadas de fagos
Los fagos codifican proteínas capaces de realizar funciones muy diversas, desde el reconocimiento y la entrada del fago en la bacteria, hasta la liberación de nuevos virus mediante la lisis gracias a enzimas que provocan la rotura de las membranas o paredes bacterianas. Estas enzimas se pueden utilizar como “enzibióticos”, aplicándolos directamente sobre las bacterias a eliminar (Domingo-Calap y Delgado-Martínez, 2018; São-José, 2018). Uno de los tipos de enzimas más utilizados son las lisinas, capaces de romper la pared celular bacteriana. Dentro de este gran grupo de enzimas se pueden distinguir las endolisinas, derivadas del ciclo lítico de los fagos que las poseen, y las lisinas asociadas a viriones (VALs), las cuales intervienen en la entrada del fago a la bacteria hospedadora (Maciejewska et al., 2018). Las endolisinas actúan en combinación con otras enzimas llamadas holinas, las cuales son capaces de formar poros en la membrana de las bacterias infectadas para que las endolisinas se liberen desde el citoplasma y degraden la pared de la misma (São-José, 2018). Al igual que los fagos, las lisinas presentan una alta especificidad (Maciejewska et al., 2018). Sin embargo, las holinas actúan sobre un amplio espectro de cepas bacterianas. Por ello, cuando se aplican endolisinas como tratamiento, suele hacerse en combinación con holinas, de forma que se amplía el rango de bacterias diana, lo cual resulta especialmente interesante para una acción conjunta frente a varias cepas MDR (Criscuolo et al., 2017; Domingo-Calap y Delgado-Martínez, 2018).
Otras enzimas de interés son las depolimerasas, capaces de degradar polisacáridos presentes en paredes, cápsulas y/o membranas bacterianas. Las depolimerasas pueden ser proteínas solubles o ir unidas a proteínas estructurales de los fagos. Pueden distinguirse en hidrolasas y liasas, en función de qué clase de enlaces rompen para degradar los polímeros (Criscuolo et al., 2017; Drulis-Kawa et al., 2015; Lin et al., 2017). Las depolimerasas suelen ser específicas, ya que en muchos casos determinan la unión fago-receptor, como ocurre en K. pneumoniae, donde las depolimerasas son dependientes del tipo capsular (Dunstan et al., 2021; Latka et al., 2021; Pan et al., 2019). Además, las depolimerasas pueden considerarse agentes antivirulencia, ya que degradan la cápsula de bacterias, como es el caso de K. pneumoniae y A. baumannii, donde ciertos tipos capsulares representan importantes factores de virulencia. En ambos casos, las cepas acapsulares son avirulentas, lo que las hace sensibles al sistema inmunitario (Oliveira et al., 2019). Por otro lado, las depolimerasas son de especial interés como herramientas para la eliminación de biopelículas debido a la naturaleza polisacarídica de la matriz extracelular. La degradación de esta matriz por depolimerasas permite alcanzar las bacterias embebidas en ella, favoreciendo su erradicación (Ferriol-González y Domingo-Calap, 2020).
Las enzimas derivadas de fagos pueden ser fabricadas y modificadas mediante biología sintética para mejorar parámetros relacionados con el espectro de acción, posibilidad de emergencia de resistencias e inmunogenicidad. Estas enzimas modificadas son de gran interés ya que reducen efectos secundarios, y además resultan útiles frente a patógenos intracelulares (Domingo-Calap y Delgado-Martínez, 2018; São-José, 2018). Un ejemplo de esta tecnología testada en modelos in vivo, es la lisina quimérica ClyR, cuyo dominio de unión a la pared celular procede de la endolisina PlySs2 de un profago de Streptococcus suis, y su dominio catalítico es el de la glicosidasa PlyC, la endolisina del fago C1 que infecta a Streptococcus sp. Esta lisina quimérica presenta mayor actividad y espectro de acción que sus parentales e incluso que otras endolisinas que afectan a Streptococcus sp., afectando a diversas especies dentro de este género incluyendo S. pneumoniae, aunque también a E. faecalis y Staphylococcus aureus. Todas estas bacterias causan enfermedades como la mastitis bovina o caries en humanos. Los ensayos in vivo se realizaron en modelos de ratón con infección sistémica de Streptococcus agalactiae y de infección dental por Streptococcus mutans (Yang et al., 2016, 2015).
Fagos en combinación con antibióticos
El uso de fagos y antibióticos no tiene por qué ser excluyente. Diversos estudios demuestran la utilidad de combinar fagos con antibióticos para tratar infecciones bacterianas. Esta idea proviene de que utilizando dos presiones selectivas frente a la bacteria se obtendrá una mayor eficacia que aplicándolas por separado (Motlagh et al., 2016; Torres-Barceló y Hochberg, 2016). De hecho, esta aproximación es muy relevante en clínica dado que en múltiples casos en los que se ha utilizado la fagoterapia en pacientes con resultados muy positivos no se remitió el uso de antibióticos durante la aplicación de fagos, produciéndose una posible acción sinérgica (Abedon et al., 2021). Uno de los casos más recientes es el de una paciente con una infección causada por Klebsiella pneumoniae MDR que fue tratada con una combinación de un fago preadaptado y antibióticos (Eskenazi et al., 2022). Sin embargo, este tipo de combinaciones pueden presentar desventajas, como la posibilidad de generar cepas con doble resistencia, tal y como puede ocurrir con los cócteles, o un favorecimiento del crecimiento de bacterias resistentes a antibióticos, dado que en algunas combinaciones fago-bacteria estudiadas los fagos han mostrado preferencia por las cepas sensibles a antibióticos (Ferriol-González y Domingo-Calap, 2020; Pena-Miller et al., 2013; Torres-Barceló y Hochberg, 2016). Por otro lado, los antibióticos pueden interferir en funciones metabólicas de la bacteria indispensables para que esta sea infectada por el fago. Esto da lugar a incompatibilidades entre ambos tratamientos y a la emergencia de efectos antagonistas (Ferriol-González y Domingo-Calap, 2020).
Las combinaciones de fago y antibiótico resultan interesantes también porque puede haber efectos sinérgicos entre ambos, conocido como efecto sinérgico fago-antibiótico (PAS). Por ejemplo, se ha observado que, en placas con cultivos bacterianos previamente tratadas con dosis subletales de antibiótico, el tamaño de las calvas de lisis provocadas por el efecto de los fagos es mayor que en ausencia de antibiótico (Kim et al., 2018). Los mecanismos por los cuales se produce el efecto PAS son muy diversos. Por ejemplo, se han estudiado múltiples combinaciones de antibióticos y fagos frente a diferentes especies bacterianas y se han observado cambios morfológicos como la formación de agregados o filamentos en las bacterias. También se observó que la presencia de antibióticos aumentaba la replicación de fagos (Kim et al., 2018; Segall et al., 2019). En última instancia, el efecto PAS es un mecanismo de adaptación de los fagos a la variabilidad del entorno. La presencia de antibióticos dificulta la supervivencia de bacterias y, por tanto, de fagos. Para enfrentarse a ello, los fagos aprovechan las alteraciones debidas al estrés causado por los antibióticos en las bacterias para maximizar su producción. Otro buen ejemplo del efecto PAS lo encontramos en un estudio en el cual se caracterizaron dos fagos a partir de aislados clínicos de A. baumannii, cuyo receptor se encuentra en la cápsula de esta bacteria. Se determinó la emergencia de mutantes resistentes al fago que perdieron la cápsula, lo cual impide la entrada del fago, pero también implica la resensibilización del mismo frente al sistema inmunitario humano, así como frente a antibióticos beta-lactámicos. Debido a esto, la terapia fágica testada en modelo de ratón infectado con A. baumannii fue efectiva (Gordillo Altamirano et al., 2021). Otro ejemplo es un estudio realizado en E. coli, en el cual se observó que el uso de fagos simultáneamente a la aplicación de antibióticos disminuía la concentración mínima inhibitoria del antibiótico, lo cual supone un efecto sinérgico (Liu et al., 2020).
El efecto PAS resulta de especial relevancia en biopelículas debido a las dificultades que presenta la eliminación de este tipo de agregados (Segall et al., 2019). Un ejemplo muy interesante es el de un paciente con una infección persistente de P. aeruginosa formando una biopelícula en una prótesis vascular. En este caso, se utilizó el fago OMKO1 en combinación con ceftazidima. El tratamiento conjunto resultó en sinergia ya que el receptor del fago son las bombas de eflujo de la bacteria, las cuales son utilizadas por la bacteria para eliminar el antibiótico de su interior y expulsarlo al medio extracelular. Las bacterias generaban resistencia al fago reduciendo la expresión de las bombas de eflujo en sus membranas, haciendo que se volvieran sensibles al antibiótico debido a la incapacidad de eliminarlo. Los resultados fueron de recuperación completa del paciente y son un claro ejemplo de efecto PAS in vivo (Chan et al., 2018, 2016).
Los fagos e incluso enzimas derivadas de ellos pueden provocar una resensibilización de bacterias MDR a antibióticos mediante otros mecanismos. De hecho, se ha explorado la posibilidad de utilizar fagos lisogénicos para introducir genes que confieren sensibilidad a antibióticos (Edgar et al., 2012). Por otro lado, en un estudio con K. pneumoniae se observó que la adquisición de resistencia mediante el plásmido mcr-1 provocaba una disminución de la carga superficial de membrana de la bacteria disminuyendo la repulsión electrostática entre un fago lítico y su receptor, favoreciendo así su adherencia e infección (Hao et al., 2019). La coevolución de bacterias MDR con fagos puede incrementar la sensibilidad a antibióticos, como se observó en un estudio con A. baumannii resistente a colistina y el fago Phab24 (Wang et al., 2021). Incluso la acción de endolisinas como ElyA1 puede resensibilizar cepas multirresistentes a la colistina de A. baumannii, P. aeruginosa y K. pneumoniae (Blasco et al., 2020).
Innovación en fagoterapia
Como hemos visto, la polivalencia de los fagos es enorme presentando muchas posibles aplicaciones y con un gran potencial terapéutico. A día de hoy, se sigue investigando sobre nuevas aplicaciones, sobre las cuales todavía es necesario profundizar. La elaboración de librerías de fagos mediante “phage display” es una herramienta con multitud de posibilidades. Recientemente, mediante esta técnica se han desarrollado librerías de endolisinas híbridas combinando dominios enzimáticos con dominios de unión a la pared bacteriana, con el objetivo de encontrar endolisinas optimizadas para su uso como antibacteriano frente a cepas MDR de S. aureus (Lee et al., 2021).
Otra línea cada vez más explorada es la ingeniería genética de fagos, la cual incrementa las posibilidades del uso de fagos y su optimización. Un ejemplo es el fago de A. baumannii Ab105-2φΔCI, modificado genéticamente para cambiar su ciclo de lisogénico a lítico, y aplicado en combinación con antibióticos (Blasco et al., 2019). Además, experimentos de evolución dirigida para obtener fagos de características deseadas mediante pases seriados o mutagénesis dirigida permiten mejorar fagos existentes de forma sencilla y económica, con el objetivo de utilizarlos por sí solos, en cócteles con otros fagos, o en combinación con antibióticos (Abdelsattar et al., 2021; Borin et al., 2021; Cebriá-Mendoza et al., 2019; Eskenazi et al., 2022).
Nuevas aproximaciones están explorando la posibilidad de combinar fagos con otros compuestos como es el caso de medicamentos anticancerígenos, para tratar infecciones con bacterias MDR. Concretamente, en un estudio reciente se combinó el fago vB_KpnM-VAC13 con mitomicina C, un anticancerígeno que en combinación con el fago se reconvierte en un antimicrobiano frente a cepas de K. pneumoniae resistentes a imipenem. En este estudio se observó que ambos agentes presentaban un efecto sinérgico aumentando la eficacia del tratamiento (Pacios et al., 2021). Como hemos visto, los caminos en la actualidad que toma la terapia con fagos son muy diversos, lo cual nos indica el gran potencial de esta herramienta y la necesidad de seguir investigando en estas áreas.
PROBLEMÁTICA DEL USO DE FAGOS EN BIOMEDICINA
El uso de fagos en biomedicina todavía presenta ciertas desventajas que resaltan la necesidad de aumentar la investigación en este campo. Uno de estos problemas es la emergencia de bacterias resistentes a fagos. Como hemos comentado previamente, las bacterias pueden desarrollar mecanismos de resistencia frente a presiones selectivas como los antibióticos o los propios fagos, lo cual también ocurre en la naturaleza. Sin embargo, existen soluciones para minimizar la emergencia de resistencias, como puede ser el uso de cócteles de fagos (que ejercen presiones selectivas diferentes) (Chan et al., 2013; Domingo-Calap y Delgado-Martínez, 2018). Otra opción es llevar a cabo experimentos de evolución dirigida en el laboratorio para favorecer la adaptación y obtener fagos capaces de contrarrestar los mecanismos de resistencia. Por otro lado, como hemos visto, la aparición de fagorresistencias no siempre es una desventaja desde el punto de vista clínico, dado que los fenotipos resistentes a fagos pueden derivar en bacterias avirulentas (Gordillo Altamirano et al., 2021).
La alta especificidad de los fagos es otra característica intrínseca que reduce efectos secundarios, manteniendo estable la microbiota beneficiosa de los pacientes tratados (Miller-Ensminger et al., 2018). Sin embargo, muchas infecciones están causadas por más de una cepa bacteriana, por lo que en algunos casos la aplicación de un tratamiento tan específico no es suficiente para erradicar la infección. El uso de cócteles de fagos también puede solventar este problema, dado que se pueden crear cócteles de varios fagos aumentando el espectro de acción de la preparación (Melo et al., 2016), o bien realizando experimentos de evolución dirigida o modificaciones genéticas y creando fagos quimera sintéticos. Para realizar un diseño de cócteles inteligente es especialmente interesante comprender dónde se localizan y cómo funcionan los receptores de los fagos, de modo que se optimiza la composición de del cóctel, además de posibilitar el descubrimiento de nuevos antimicrobianos y dirigir la evolución de otros fagos hacia fenotipos de interés (Gordillo Altamirano y Barr, 2021).
Independientemente a estas posibles desventajas intrínsecas a la naturaleza de los fagos, existen limitaciones de tipo legislativo para su aplicación tanto en medicina como en otras áreas. La regulación actual de productos farmacéuticos no está ideada para productos de medicina personalizada capaces de evolucionar. La Unión Europea, por el momento, no está abierta a cambiar la legislación al respecto para favorecer terapias menos convencionales como la terapia con fagos (Fauconnier, 2019). En Bélgica se han comenzado a establecer algunas bases legales al respecto, requiriéndose extensa documentación sobre los fagos, así como la existencia de laboratorios que controlen los “stocks” y aseguren la calidad de los mismos (Fauconnier, 2017). En Francia, se ha establecido un comité especializado que realiza recomendaciones y permite el uso de productos médicos sin autorización de venta cuando no existe ningún tratamiento alternativo (ANSM, 2019). Por último, como se ha comentado previamente, en Estados Unidos se ha autorizado recientemente el uso de fagos frente a las bacterias MDR en hospitales en pacientes COVID-19 en cuidados intensivos.
CONCLUSIONES
Las infecciones bacterianas causan un importante impacto en la salud global, y requieren de soluciones a corto plazo para reducir su prevalencia y sobretodo, evitar la emergencia de cepas MDR. El uso indiscriminado de antibióticos ha provocado que muchas infecciones bacterianas sean muy difíciles de erradicar por métodos tradicionales, poniendo de relevancia la necesidad de desarrollar métodos alternativos a los antibióticos que sean eficaces para tratar este tipo de infecciones. Es por ello que los fagos se postulan como una de las alternativas más prometedoras en la lucha contra bacterias MDR. Su elevada especificidad, así como su capacidad de multiplicarse en el lugar de infección y de coevolucionar con sus bacterias hospedadoras, son algunas de sus ventajas. Los fagos también presentan una elevada polivalencia, ya que se pueden utilizar tanto por sí solos como en cócteles, en combinación con antibióticos o modificados genéticamente. Además, sus aplicaciones abarcan otras áreas como la agricultura, la ganadería o la veterinaria, pudiéndose usar no solo como tratamiento, sino también en prevención y en diagnóstico. Sin embargo, la fagoterapia presenta todavía inconvenientes, como son la falta de legislación y de medidas regulatorias. Actualmente, solo se permite su uso en casos muy particulares y como tratamiento compasivo, aunque cabe destacar que los resultados están siendo muy alentadores. Las perspectivas para su aplicación en clínica requieren de una mayor investigación en el área, lo que conlleva una mayor inversión. Finalmente, cabe destacar la importancia de la aceptación del público general, y para ello es especialmente relevante realizar labores de divulgación a nivel social para dar a conocer esta terapia y favorecer una modificación de la legislación actual para su uso a nivel global.
Patrocinios o becas
Este trabajo ha sido financiado por el Ministerio de Ciencia e Innovación (contrato Ramón y Cajal, RYC2019-028015-I a PD-C), proyecto PID2020-112835RA-I00 financiado por MCIN/ AEI /10.13039/501100011033, y proyecto SEJIGENT/2021/014, financiado por la Conselleria d’Innovació, Universitats, Ciència i Societat Digital (Generalitat Valenciana).
Declaración de ausencia de conflictos de intereses.
Las autoras declaran la ausencia de conflicto de intereses.

