INTRODUCCIÓN
El 25 de noviembre del año 2018, en China, el científico He Jiankui daba a conocer al mundo la creación de los primeros seres humanos genómicamente modificados empleando la técnica CRISPR/Cas9. A espaldas de la comunidad científica mundial, y contradiciendo incuestionables estándares técnicos y bioéticos, He había creado a las gemelas Lulu y Nana con el afán de inducir resistencia al virus de inmunodeficiencia humana (VIH) a hijos descendientes de portadores del mismo. Todo ello, a pesar que actualmente existen alternativas de concepción seguras en descendientes de parejas serodiscordantes, las cuales incluyen terapia antirretroviral, uso de medicamentos profilácticos, autoinseminación vaginal y lavado seminal. Cerca de cumplirse un año de este suceso, el presente artículo de difusión tiene como objetivo discutir sobre los motivos que justificaron el experimento de He.
¿Por qué inducir resistencia natural al VIH a descendientes de padres serodiscordantes? Explicando el propósito de la investigación de He
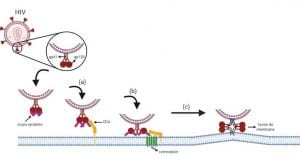
Ciclo viral del VIH: Entrada a la célula
El VIH pertenece al género Lentivius (familia Retroviridae) que causa infección por VIH y que más tarde se puede convertir en el Síndrome de Inmunodeficiencia Adquirida (SIDA). El genoma de este virus está compuesto por ARN monocatenario positivo (ARNmc+) por lo que precisa de la enzima viral transcriptasa inversa (retrotranscriptasa) que transforma su ARN en ADN (Fanales et al., 2010). Además, puede integrar su material genético dentro del genoma del huésped por medio de la enzima viral integrasa. Una vez ocurrido esto, el virus utiliza la maquinaria celular para traducir sus proteínas virales y poder replicarse.
La duración y el resultado de la infección viral por VIH depende del tipo de célula huésped y la activación celular (Simon et al., 2006). Sin embargo, existen ciertas etapas del ciclo viral que están conservadas, como es el caso de la entrada a la célula. La interacción entre virus y la célula objetivo empieza con dos proteínas virales de membrana: i) la glicoproteína externa (gp120) y, ii) la proteína transmembrana (gp41), que forman un pico en la superficie del virión.
La proteína gp120 se une al receptor CD4+ (Figura 1a), seguidamente, se produce una segunda interacción con un correceptor de quimiocinas (CCR5 o CXCR4) (Figura 1b). Estas uniones producen un cambio conformacional irreversible, donde gp41 se introduce dentro de la membrana celular (Figura 1c), induciendo la formación de un poro mediante la fusión de membranas. Seguidamente, ocurre la liberación del núcleo viral dentro del citoplasma de la célula huésped (Simon et al., 2006). Adicional a esto, Arthos y colaboradores (2008) identificaron que la integrina α4β7 es un receptor celular adicional que el VIH utiliza como entrada. En este caso, la proteína gp120 se une a la integrina α4β7 que induce la activación de la integrina LFA-1 (antígeno 1 asociado a la función linfocitaria), de tal forma que se induce la formación de sinapsis virológicas.
Linfocitos T colaboradores: Células diana del VIH
De manera general, los linfocitos T colaboradores tienen un rol importante en el sistema inmune ya que se encargan de activar y direccionar otras células inmunitarias, así como de participar en la respuesta inmune adaptativa. Todos los linfocitos maduros expresan proteínas CD4 en la membrana, llamándose así linfocitos T CD4+. Estas células están involucradas en varios procesos, por lo que son transcendentales en el funcionamiento del sistema inmune.
Las células CD4+ estimulan la producción de anticuerpos específicos mediante células B, implicadas en la activación y el crecimiento de células T citotóxicas (células T CD8+), además de regular la función de macrófagos, la respuesta contra microorganismos patógenos y la autoinmunidad (Alberts et al., 2014). Por ello, se considera que los linfocitos T CD4+ son los intermediarios más importantes en el sistema inmune adquirido. Cuando estas células se ven afectadas, es decir, cuando los niveles disminuyen o pierden sus funciones, el sujeto se vuelve vulnerable hacia cualquier tipo de microorganismo infeccioso (Zhu et al., 2010). Precisamente, esto es lo que ocurre cuando una persona contrae VIH y no es tratada. Pasado cierto tiempo, su sistema inmune se verá comprometido y probablemente desarrolle SIDA.
Resistencia natural al VIH: rol del gen CCR5 elegido por He en sus experimentos
Como ya se mencionó en la sección anterior, el VIH utiliza el receptor CD4+ y los correceptores integrina α4β7 y quimiocinas CXCR4 o CCR5 (Figura 1.d) para ingresar en las células diana, siendo este último correceptor el más utilizado por el virus (Hütter et al., 2015). Por ello, el científico He Jiankui buscó inhibir in vivo el gen que transcribe la proteína quimiocina CCR5 mediante CRISPR/Cas9 en células embrionarias (células totipotentes). La principal justificación de esta modificación genética son los casos reportados de individuos que presentan resistencia natural al VIH por una modificación en el gen CCR5. La primera vez que se evidenció esto fue en 1996, donde Samson y colaboradores pudieron apreciar que un alelo mutante de CCR5 está presente en una alta frecuencia en poblaciones caucásicas (10%) y, con menor frecuencia, con ambos alelos (1%). La modificación consiste en una deleción de 32 pares de bases en el tercer exón de CCR5, introduciendo un codón de parada que resulta en la traducción de una proteína no funcional (CCR5Δ32). Esta mutación tiene un origen reciente y la distribución geográfica está concentrada principalmente en Europa. En la actualidad, se manejan dos hipótesis que podrían explicar el origen evolutivo del alelo CCR5Δ32. Una de ellas, es la peste bubónica, que se piensa que impulsó la presión evolutiva en la población europea (Galvani y Slatkin, 2003).
Los individuos homocigotos, aquellos que presentan la mutación en ambos alelos, son resistentes al virus a pesar de las múltiples exposiciones de alto riesgo (Lui et al., 1996). Mientras que los individuos heterocigotos, aquellos que tienen un solo alelo mutante, expresan menos del 50% de quimiocinas CCR5. Esto les permite ser más resistentes al VIH, ya que la carga viral es menor y la posible progresión del SIDA es más lenta (Benkirane et al., 1997). Por lo tanto, el genotipo homocigoto, denominado CCR5Δ32/Δ32, confiere protección contra la infección por VIH en grupos que aún no han sido infectados, es decir, confiere resistencia al virus (Ni et al., 2018).
En la actualidad, desarrollar un método que otorgue resistencia natural al VIH es uno de los objetivos más importantes que se proponen muchos grupos de investigación en todo el mundo. En este sentido, uno de los acercamientos para llegar a dicho objetivo son las estrategias para inhibir la expresión de CCR5 en la membrana celular. Existen varias técnicas moleculares que permiten realizar modificaciones genéticas, como las nucleasas con dedos de zinc (ZFN), las nucleasas efectoras activadoras de la transcripción (TALEN), CRISPR/Cas9 y ARN de interferencia (siRNA), entre otras (Hütter et al., 2015). Un gran avance en terapia génica ocurrió en el año 2007, cuando un paciente de Berlín infectado con VIH desarrolló leucemia mielógena aguda (LMA), el cual fue tratado con un trasplante alogénico de células madre hematopoyéticas de un donante homocigoto CCR5Δ32 (Yukl et al., 2013). Posteriormente, no se detectaron rastros de material viral competente para la replicación en el paciente, por lo que representa la primera persona en ser “curada” de la infección por VIH. Esta fue la primera evidencia de que el trasplante de células madre modificadas podría inducir resistencia hacia el VIH.
Este resultado motivó a los científicos a seguir buscando la “cura” contra el VIH. Hasta la fecha, se han desarrollado una gran cantidad de experimentos donde se utiliza CRISPR/Cas9 para inducir la modificación homocigota CCR5Δ32 en líneas celulares humanas de células T CD4+ (Liu et al., 2017; Qi et al., 2018), en células madre pluripotentes inducidas (iPSCs) (Kang et al., 2015) y embriones humanos 3PN (Kang et al., 2016). Cabe mencionar, que antes del 25 de noviembre de 2018, dichas modificaciones se habían realizado únicamente in vitro y en ningún caso se había obtenido el 100% de efectividad.
Desencadenamiento de eventos desde las gemelas CRISPR
Desde que se determinó que el sistema de CRISPR/Cas9 puede utilizarse para la edición genómica ha existido un sinnúmero de investigaciones acerca de las diferentes aplicaciones que puede ofrecer el sistema CRISPR/Cas9. En mamíferos, todas las investigaciones habían sido realizadas en animales modelos y en líneas celulares humanas que no tienen viabilidad. Sin embargo, desde que se dio la noticia de las primeras gemelas CRISPR creadas por He, se inició una cascada de eventos sobre edición genómica en células germinales humanas (Lovell, 2019).
Entre ellas, llama poderosamente la atención la propuesta del biólogo ruso Denis Rebrikov que planea crear más bebés CRISPR. El objetivo de Rebrikov es suprimir el mismo gen CCR5 con el que He trabajó para evitar la transmisión del VIH en los hijos de parejas serodiscordantes. La única diferencia de este experimento con el de He, es que Rebrikov realizará su trabajo con madres seropositivas, que según varios expertos tiene mayores beneficios clínicos debido a que existe un menor riesgo de contagio. Además, Redrikov señala que sólo realizará edición genómica en el caso que las madres no respondan a tratamientos estándares (Cyranoski, 2019).
Las modificaciones en células embrionarias no son el único enfoque controversial que se está utilizando para disminuir el riesgo de enfermedades hereditarias, debido a que también están trabajando con modificaciones en espermatozoides. En el laboratorio de Well Cornell Medicine en New York están trabajando con ediciones genéticas en espermatozoides humanos para prevenir los trastornos causados por mutaciones genéticas que se transmiten de los hombres, tales como la infertilidad. Según Gianpiero Palermo, director del laboratorio, este experimento tiene como objetivo la modificación del gen BRC1 (Stein, 2019). Sin embargo, se ha evidenciado que la mutación en este gen, que posee 22 exones y se expresa en varios tejidos como el mamario y ovárico (Albertsen, 1994), está relacionado con diferentes tipos de cánceres, principalmente el de mama (Kwong et al., 2011). Por lo tanto, la modificación genética en líneas celulares germinales, en este caso espermatozoides, abre nuevamente el debate sobre los beneficios y desventajas que conlleva el uso de CRISPR/Cas9.
Conclusiones
El tema de la edición del genoma humano siempre ha sido y será un tema controversial, ya que abarca aspectos técnicos, bioéticos, morales y religiosos que no pueden pasar inadvertidos. La “fábula” o la “barbarie” de He abrió de manera abrupta un debate en la comunidad científica mundial sobre las tecnologías de edición genómica en humanos que había sido postergado. Sólo era cuestión de tiempo para que esta inminente realidad llegara para instalarse y cambiar el rumbo de la humanidad y su evolución, siendo esta vez dirigida por el hombre. Ojalá que la “fábula” no se trate de una “barbarie” sino de un cuento donde suceden cosas prodigiosas, como haber realizado la primera edición de genomas humanos en la historia de la humanidad. Ojalá que la “fábula” se trate de una estrategia hegemónica para enredar y confundir a los ingenuos o a los incautos, con la intención de asegurar mediáticamente haber llegado a la luna sin haberlo hecho, como marcar un territorio inexplorado sin haberlo conquistado.

