Todos hemos oído hablar del cáncer. Tenemos el concepto de que es una enfermedad que afecta a muchas personas y puede llegar a causar la muerte. También que la genética interviene en el cáncer.
Ciertamente, el cáncer afecta a muchas personas. Solo el año pasado se registraron más de 19 millones de nuevos casos y murieron casi 10 millones de personas por esta causa. De hecho, el cáncer es la segunda causa de muerte en el mundo.
Pero el cáncer no es una única enfermedad. A nivel clínico, el cáncer es multitud. La palabra “cáncer” engloba a múltiples enfermedades que pueden ser diferentes en su comportamiento o en su forma de avanzar, según a qué tipo de células o tejidos afecta. Por ejemplo, los síntomas de una leucemia, que afecta a las células de la sangre, no son los mismos que los de un tumor cerebral.
Eso sí, todos los cánceres comparten unas características básicas, que son las que hacen que se utilice una palabra única para englobarlos. El primer factor común es que el cáncer es una enfermedad genética, causada por alteraciones en el ADN (la cuestión, como veremos es cómo se adquieren esas mutaciones).
Otra de las cosas comunes que presentan las enfermedades agrupadas como “cáncer” son las siguientes características biológicas:
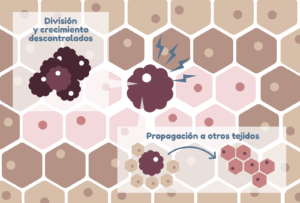
- El crecimiento y división descontrolados
- Y la capacidad de propagación a otros tejidos u órganos, fenómeno conocido como metástasis.
¿Cómo se produce un cáncer?
En la mayoría de los casos el cáncer se produce por la aparición de mutaciones genéticas (en la secuencia de ADN) o epigenéticas (en mecanismos que influyen en la regulación de los genes sin afectar a la secuencia de ADN) en genes de susceptibilidad al cáncer. Pero no se trata de cualquier tipo de mutación, sino de mutaciones específicas: unas que llevan a que las células pierdan el control del ciclo celular y puedan empezar a ganar “poderes” o características biológicas que favorezcan su supervivencia.
Entre estas características o superpoderes destacan:
- La capacidad energética para mantener una proliferación continuada. Las células tumorales son células con grandes requerimientos energéticos así que deben adaptarse a obtener energía de donde puedan. Pueden incluso reprogramar su metabolismo, si es necesario, para adaptarse a sus nuevas necesidades.
- La evasión de las señales para suprimir el crecimiento. Las células tumorales no respetan los semáforos celulares que indican que es el momento de detener el crecimiento.
- Capacidad para evadir la muerte celular programada y no verse afectadas por las múltiples divisiones. Normalmente, las células tienen una suerte de “obsolescencia programada”, un número límite de divisiones que pueden tolerar antes de que se produzcan alteraciones en sus cromosomas. Cuando llega ese momento y en otras situaciones de estrés, las células activan programas de muerte celular programada como medida de control para evitar que la acumulación de daños pueda repercutir en el funcionamiento o generar problemas a otras células. Las células del cáncer consiguen evitar esos programas y se adaptan a las múltiples divisiones. ¿Cómo? Por ejemplo, activando la telomerasa, para evitar el acortamiento de sus telómeros.
- Capacidad para inducir la formación de vasos sanguíneos, por donde pueden obtener nutrientes o establecer vías para invadir otros tejidos e iniciar lo que se conoce como metástasis.
- Evasión de la acción del sistema inmunitario, algo esencial para no ser reconocidas como perjudiciales (son células sin control) y ser eliminadas.
En resumen, aunque nuestro organismo tiene sistemas para detectar y detener a las células que pierden el control de la división y crecimiento, las células del cáncer son expertas en adquirir características para evitar esos sistemas. Pero ojo, no toda alteración en proliferación o crecimiento celular lleva a un cáncer maligno.
También hay que considerar que la formación de un tumor no es algo inmediato. Es un proceso progresivo a través del cual se van acumulando cambios genéticos y epigenéticos que llevan a que las células adquieran las características beneficiosas para ellas que mencionamos anteriormente. Para aquellos que juegan videojuegos, es como si al producirse ciertas mutaciones, las células tumorales fueran desbloqueando logros cada vez más beneficiosos para ellas y perjudiciales para el organismo.
Por otra parte, la acción de ciertos virus también puede causar cáncer. Hasta el momento se han descrito 7 virus (EBV, HTLV-1, HPV, HBV, HCV, KSHV y MCV) que son responsables de más de un 11% de los casos de cáncer diagnosticados. Uno de los más conocidos es el virus que causa el papiloma humano. ¿Cómo pueden los virus producir cáncer? Pueden alterar el comportamiento de las células y causar daño en su ADN.
¿QUÉ FACTORES INFLUYEN EN LA APARICIÓN DE UN CÁNCER?
Ya hemos visto que todos los cánceres son genéticos y se producen cuando las células pierden el control del ciclo celular y adquieren otras características. Sin embargo, no todos los cánceres son hereditarios y se transmiten de una generación a otra.
En la aparición de las mutaciones responsables de la enfermedad pueden influir diferentes factores. Algunos de ellos como el consumo de tabaco o la exposición al sol se pueden prevenir. Otros, como la edad o predisposición genética, no.
Al igual que ocurre con otros tipos de enfermedades, como las cardiovasculares, comer una dieta saludable, tener actividad física y mantener un peso saludable puede reducir el riesgo de algunos cánceres. De hecho, se estima que entre el 30% y el 50% de las muertes por cáncer podrían evitarse a través de estrategias de prevención basadas en evidencias.
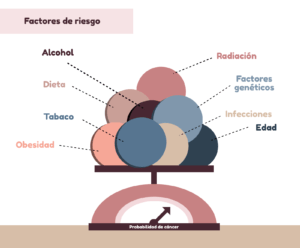
Veamos algunos de estos factores de riesgo del cáncer:
- El consumo de alcohol aumenta el riesgo de cáncer de boca, garganta, esófago, laringe, hígado y mama.
- Estudiar el efecto de la dieta en el desarrollo del cáncer es complicado, debido a que hay que considerar todo tipo de nutrientes y sustancias presentes en la comida y bebida. No obstante, sí se sabe que una dieta sana con fibra abundante y la reducción en el consumo de carne roja o procesada disminuyen el riesgo a desarrollar cáncer de colon. Por otra parte, comer grandes cantidades de salazones está relacionado con un mayor riesgo a tener cáncer de estómago. Si te interesa este tema, puedes consultar esta revisión reciente sobre dieta, nutrición y riesgo a desarrollar cáncer.
- Las personas con obesidad tienen mayor riesgo a varios tipos de cáncer como el cáncer de mama, de colon, de recto, de esófago o páncreas.
- En la actualidad es la principal causa de cáncer y de muerte por cáncer. El consumo de tabaco causa diferentes tipos de cáncer como cáncer de boca, esófago, garganta, pulmón, hígado, estómago, páncreas, colon, y recto, entre otros. Esto es debido a que el consumo activo o pasivo libera muchos compuestos químicos que pueden dañar el ADN de las células.
- Algunos virus y bacterias pueden causar cáncer. Algunos ejemplos son el virus de la hepatitis B o la bacteria Helicobacter pylori.
- Radiación. Ciertas radiaciones, como los rayos X, radiación ionizante, o rayos gamma pueden dañar el ADN y por tanto producir cáncer.
- Exposición al sol. La exposición excesiva a radiación UV del sol o de las lámparas solares pueden inducir daños en el ADN de las células de la piel y causar cáncer de piel.
- El cáncer puede ocurrir a cualquier edad y algunos tipos son más frecuentes en niños. No obstante, la edad avanzada es el factor de riesgo más importante, para la mayor parte del cáncer. Por ejemplo, un 25% de los casos nuevos de cáncer se diagnostican en personas de 65 a 74 años.
- Factores genéticos hereditarios de predisposición al desarrollo de cáncer. La mayor parte de los cánceres se producen por mutaciones somáticas, no heredadas de los progenitores. No obstante, en algunos casos sí hay factores genéticos hereditarios implicados, que pueden transmitirse de una generación a otra.
TIPOS DE CÁNCER
Estamos acostumbrados a clasificar el cáncer según el tejido donde se produce. Sin embargo, a nivel molecular, las cosas son diferentes.
Por ejemplo, ciertos cánceres de diferentes tejidos comparten las mismas alteraciones moleculares y son más parecidos biológicamente entre ellos que con otros tumores del mismo origen.
Si consideramos cuál es el origen genético de la enfermedad, el cáncer puede considerarse hereditario, familiar o somático.
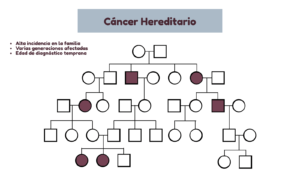
Cáncer hereditario
El cáncer hereditario es aquel que se produce debido a la presencia de mutaciones germinales (en los gametos) en genes de susceptibilidad al cáncer. Es el menos frecuente, y representa alrededor un 5% de todos los cánceres.
Este tipo de cáncer, o más bien, la susceptibilidad al mismo puede ser transmitida a la descendencia. Hablamos de susceptibilidad porque la transmisión de la mutación no implica que la persona portadora vaya a desarrollar irremediablemente un cáncer. Otros factores como el estilo de vida pueden influir también en su aparición.
Dentro de los síndromes de cáncer hereditario destacan el cáncer de mama y ovario hereditario, causados, entre otros por mutaciones en los genes BRCA1 y BRCA2, y el cáncer de colon familiar, causado principalmente por el gen APC.
¿Cuándo sospechar que puede existir un síndrome de cáncer hereditario? Si se observa:
- Alta incidencia de cáncer en la familia.
- Varias generaciones afectadas.
- Edad de diagnóstico del cáncer por debajo de lo habitual.
- Cáncer bilateral, que se presenta, por ejemplo, en ambos pulmones.
En el caso del cáncer hereditario, cuando se diagnostica a un paciente, es importante considerar que puede haber otros miembros de la familia afectados. Además, una vez diagnosticado un cáncer hereditario, conocer la causa genética permite evaluar el riesgo a transmitirla a la descendencia, algo que no es posible en otros tipos de cáncer que no siguen patrones de herencia concretos.
Cáncer familiar
El cáncer familiar hace referencia a la observación de una agregación de familiares con cáncer de distinto tipo, que apunta a que exista una susceptibilidad genética hereditaria, pero donde no se ha identificado un gen responsable. Representa entre un 15 y un 20% de los casos.
Cáncer somático
El cáncer de tipo somático, que es el cáncer más frecuente, se produce por mutaciones adquiridas por la persona durante su desarrollo o a lo largo de su vida. Esto quiere decir que las mutaciones causales no se transmiten a la descendencia.
¿Cómo se producen estas mutaciones? Por errores en la maquinaria de replicación del ADN de la célula o por la acción de agentes externos como la radiación UV u otros agentes cancerígenos.
MUTACIONES EN CÁNCER
Hemos repetido varias veces que el cáncer es una enfermedad genética producida por alteraciones genéticas o epigenéticas. Ahora bien, ¿Cuáles son esas mutaciones? ¿Dónde se producen? ¿Hay unas más importantes que otras?
Para empezar, recordemos que no toda mutación o cambio en el ADN tiene un efecto negativo. Por lo tanto, no toda mutación en el ADN de una célula va a derivar en un cáncer. Las mutaciones importantes, las que pueden causar mayores problemas en relación con el cáncer son aquellas que ocurren en genes relacionados con la reparación del ADN o con el crecimiento o el ciclo celular. Básicamente, son las mutaciones que contribuyen a que las células tumorales adquieran sus características.
Por ejemplo, una mutación que comprometa la función de gen responsable de controlar el ciclo celular y enviar la señal de “esta célula no puede dividirse” puede facilitar que la célula siga dividiéndose cuando no le corresponda. Es como si se rompieran los frenos de un coche.
Gracias al trabajo de numerosos investigadores y equipos, hoy en día se conocen muchas de las mutaciones habituales del cáncer, así como muchos genes que cuando están alterados pueden influir en la aparición o avance de la enfermedad.
Se sabe por ejemplo que, cuando algunos genes que intervienen en la proliferación y crecimiento celular sufren ciertos cambios estructurales o funcionales se comportan como “gemelos malvados” que en lugar de controlar que todo vaya bien promueven el caos y el desarrollo de procesos tumorales. Estas versiones alteradas, conocidas como oncogenes, suelen ser versiones activadas del gen y dominantes, de forma que solo necesitan producirse en una de las dos copias que suele haber de cada gen para contribuir al inicio de un tumor. El gen KRAS es un ejemplo de oncogén. Este gen codifica para una proteína que interviene en rutas de señalización celulares relacionadas con el crecimiento y la división.
Otros genes, los conocidos como supresores de tumores, suelen contribuir al cáncer cuando su función desaparece. Estos genes suelen actuar como reguladores de procesos o en reparación del ADN. Un ejemplo muy conocido de gen supresor de tumores es el que codifica para la proteína p53, conocida como el Guardián del Genoma por su función en la detección y reparación de daños en el ADN. Cuando se detectan daños en el ADN que pueden repararse, p53 alerta de la situación y activa genes que intervienen en la reparación. El gen que codifica p53, además, es el que aparece mutado con más frecuencia en cáncer.
Además, en cáncer se habla de mutaciones driver o conductoras, y mutaciones passenger o pasajeras para diferenciar la función de las mutaciones en el proceso tumoral.
Las mutaciones driver, también llamadas directoras o inductoras del cáncer, son, como su nombre indica las que dirigen el proceso tumoral. Este tipo de mutaciones proporcionan a las células las ventajas o “superpoderes” que comentamos anteriormente, como la capacidad para evadir al sistema inmunitario o inducir la formación de vasos sanguíneos. Un ejemplo de estas mutaciones son las mutaciones activadoras de oncogenes.
Las mutaciones passenger o pasajeras son mutaciones somáticas que en principio no tienen consecuencias funcionales en la eficacia del tumor. Se llaman así porque son arrastradas por la selección de otras variantes.
Cuando los investigadores analizan el genoma del tumor de un paciente detectan tanto las mutaciones driver como las pasajeras. Diferenciar entre ambos tipos es un paso esencial para saber cómo se produce el cáncer y cómo evoluciona. Y también para desarrollar aproximaciones terapéuticas, ya que el objetivo principal será actuar frente a las mutaciones driver.
¿Y las alteraciones epigenéticas en cáncer?
Las células tumorales no solo presentan mutaciones que afectan a la secuencia del ADN. Además de la variación genética suelen presentan alteraciones epigenéticas que contribuyen la biología del cáncer, como patrones de metilación o modificaciones de las histonas anómalos. Estos cambios influyen en la expresión de los genes (y en el desarrollo o avance del tumor) pero no influyen en la secuencia del ADN.
En los últimos años existe un gran interés en identificar estas alteraciones porque pueden servir para desarrollar tratamientos dirigidos a ellas. Algunas terapias dirigidas a modificaciones epigenéticas ya han sido aprobadas. Una de ellas es Vidaza, fármaco que inhibe la metilación y resulta tóxico para las células en división que no responden a mecanismos de control del crecimiento (como son las células tumorales).
Además de su papel en el desarrollo de tratamientos las alteraciones epigenéticas también pueden resultar biomarcadores de interés para detectar el cáncer o informar sobre la evolución del tumor o la respuesta a la terapia. Por ejemplo, como los patrones epigenéticos de cada tipo celular son específicos, se pueden analizar el ADN de un tumor secundario o de una biopsia líquida (que analiza la presencia de ADN tumoral liberado por las células del cáncer al torrente sanguíneo) para determinar el origen inicial del cáncer. Las células cancerosas, derivarán de una célula en un tejido e independientemente de si han dado lugar a tumores en otros tejidos, mantendrán su perfil epigenético original.
IMPORTANCIA DE LA GENÉTICA Y GENÓMICA EN ONCOLOGÍA
Siendo como es el cáncer una enfermedad de origen genético el desarrollo de la genética y la genómica en los últimos años, ha sido un factor clave para impulsar su investigación y empezar a tener aplicaciones directas en su diagnóstico y manejo.
Gracias a diferentes proyectos y consorcios ahora sabemos que:
- En la aparición y desarrollo del cáncer intervienen alteraciones en ADN que afectan a cómo funcionan las células.
- Los tumores son poblaciones heterogéneas de células donde conviven células tumorales y células inmunitarias.
- El ADN, ARN y perfiles epigenéticos de las células tumorales de una persona pueden proporcionar información útil sobre su cáncer
- Existen perfiles genéticos concretos en algunos tipos de cáncer que pueden ser utilizados con diferentes fines clínicos.
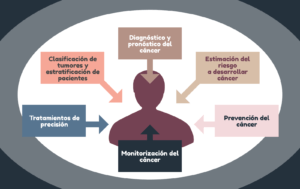
Además, en los últimos años se han derivado múltiples aplicaciones de la genética en la práctica de la oncología. Veamos algunas de ellas:
Estimación del riesgo a desarrollar un cáncer
Al igual que ocurre con otras enfermedades como las cardiovasculares o las neurológicas, el genoma que una persona hereda de sus progenitores puede ser evaluado para estimar cuál es su predisposición genética “de fábrica” a desarrollar un cáncer.
La precisión y relevancia de esta estimación depende del tipo de cáncer.
En el caso del cáncer hereditario, la identificación de una variante que confiere un elevado riesgo a tener un cáncer puede tener especial importancia. Por una parte, puede facilitar que la persona afectada se haga más chequeos o se someta a cirugías profilácticas, como hizo Angelina Jolie. La actriz, que había perdido a su madre, a su abuela y a una tía por cáncer, era portadora de mutaciones en el gen BRCA1 y tomó la decisión de someterse a una doble mastectomía preventiva. Posteriormente, a raíz de la detección de signos tempranos de cáncer de ovario también se sometió a una doble ovariectomía preventiva. Por otra parte, la detección de variantes de riesgo implica que otros familiares pueden estar afectados.
Para los cánceres no hereditarios, la estimación del riesgo es más complicada ya que solo se conocen algunas variantes de predisposición. En este caso la aplicación clínica está menos clara.
Genética en prevención del cáncer
¿Cómo contribuye la genética en la prevención el cáncer? En primer lugar, hay que considerar que cada persona puede tener una predisposición genética «de fábrica» diferente. Esta predisposición es especialmente relevante en los casos de cáncer hereditario. En estos casos conocer el riesgo puede ayudar a establecer un protocolo de acción dirigido a detectar el cáncer lo antes posible.
Además, en la actualidad se realizan diferentes investigaciones dirigidas a mejorar la prevención en cáncer no hereditario. Por ejemplo, hay estudios que evalúan cómo afectan los factores ambientales o de estilo de vida al ADN. Por ejemplo, se sabe que algunos agentes ambientales como la radiación UV producen ciertos patrones de cambios en el ADN relacionados con el cáncer. Además, la secuenciación del ADN puede permitir relacionar la aparición de alteraciones en el ADN con otros agentes, y derivar en políticas de prevención. Por otra parte, aunque es un área todavía en investigación, la secuenciación del ADN podría detectar lesiones premalignas, a través de la identificación de patrones de mutación característicos de fases previas al cáncer.
Genética en diagnóstico y pronóstico del cáncer
Antes de que empezaran a estudiarse las características moleculares de los cánceres, el diagnóstico se realizaba principalmente a partir del tejido o órgano afectado y de las características que se encontraban al analizar una muestra de tumor en el microscopio. Este tipo de diagnóstico limitaba las opciones terapéuticas y derivaba en que muchos cánceres similares a gran escala, pero con diferente motor genético, se trataran de forma similar.
Ahora, gracias a la caracterización molecular y genética que se ha realizado en los últimos años de muchos tipos de cáncer se sabe que algunos de ellos están asociados a cambios genéticos concretos. Esta situación permite ofrecer un diagnóstico mucho más preciso del paciente. Por ejemplo, lo que hace unas décadas se consideraba un cáncer de pulmón, ahora puede ser un cáncer de pulmón no microcítico con mutación en el gen EGFR.
Además, en casos de cáncer familiar, el asesoramiento genético puede aumentar la probabilidad de realizar un diagnóstico precoz de la enfermedad, gracias al conocimiento previo obtenido de otros miembros de la familia.
¿Cómo se realiza el diagnóstico genético o molecular del cáncer?
Normalmente, se realiza una biopsia al paciente en la que se toma una muestra de tejido sano y una muestra de tejido tumoral. Posteriormente se compara el ADN obtenido del tumor con el ADN del tejido sano, que se corresponde con recibido de sus progenitores.
Además, en la actualidad, están cobrando mucho interés las biopsias líquidas, basadas en la detección en sangre de fragmentos de ADN tumoral liberados al torrente sanguíneo (u otros fluidos) por las células del cáncer cuando mueren. Otra versión de biopsia líquida analiza directamente las células tumorales circulantes, que son células que se han separado del tumor al que pertenecen. Las biopsias líquidas tienen como principal ventaja que no resultan tan invasivas como otro tipo de biopsias y que proporcionan una visión de lo que ocurre en el organismo en el momento en el que se toma la muestra. Sin embargo, la cantidad de ADN tumoral es baja, lo que presenta algunas limitaciones técnicas.
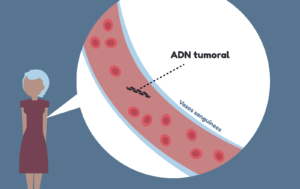
Volviendo al tema del diagnóstico, conocer el subtipo molecular o genético de un cáncer, puede facilitar la emisión de un pronóstico sobre cómo podría evolucionar el tumor, o apuntar a fármacos concretos que puedan utilizarse como tratamiento. Por ejemplo, los pacientes con leucemia mieloide aguda en los que se detecta una mutación en el gen FLT3 en sus células tumorales tienen un peor pronóstico que los pacientes cuyas células no son portadoras de esa mutación.
Clasificación de tumores y estratificación de pacientes
Además de facilitar el diagnóstico, conocer las características genéticas de un tumor amplia el número de variables o criterios que se utilizan para clasificar el cáncer.
¿En qué ayuda mejorar la clasificación del cáncer? Los pacientes están mejor caracterizados, lo que puede derivar en tratamientos más específicos. Y, además, se facilita el diseño de ensayos clínicos que evalúen aproximaciones terapéuticas o tratamientos.
El cáncer de mama es un ejemplo de la utilidad de la genética en la clasificación de tumores. Se pueden diferenciar cuatro subtipos principales de cáncer de mama, según los niveles de expresión del receptor de estrógenos (ER), receptor de progesterona (PR) o el factor de crecimiento epidérmico humano 2 (HER2). A los pacientes de cada subtipo se les asigna un tratamiento específico.
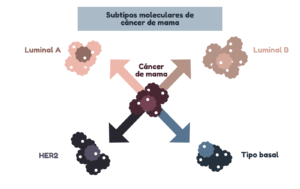
El tratamiento de un cáncer según sus alteraciones genéticas podría llevar a que un cáncer de mama y un cáncer de páncreas con sobreexpresión de HER pudieran llegar a ser tratados con la misma estrategia. En la actualidad, algunos ensayos clínicos evalúan tratamientos dirigidos a perfiles moleculares concretos, independientemente del tipo de cáncer. Otro diseño de ensayo clínico prueba fármacos dirigidos a diferentes alteraciones genéticas de un mismo tipo de tumor.
De la genética del cáncer a los tratamientos de precisión
La clasificación genética del cáncer ha abierto un abanico de posibilidades terapéuticas, algunas de las cuales ya se utilizan en la práctica clínica.
En algunos tipos de cáncer colorrectal, cáncer de mama, cáncer de pulmón, leucemia, linfoma, melanoma o cáncer de ovario o tiroides ya existen ejemplos de medicina de precisión donde se considera el perfil genético del tumor a la hora de decidir el tratamiento y hay tratamientos dirigidos a alteraciones concretas.
Por ejemplo, el fármaco Gefitinib, basado en un inhibidor de una proteína asociada a EGFR, se utiliza en pacientes con carcinoma de pulmón no microcítico con mutaciones activadoras en EGFR.
El mayor reto en el desarrollo de estas terapias dirigidas a células tumorales concretas es identificar mecanismos y procesos específicos de las células tumorales y evitar que las células tumorales utilicen sus “superpoderes” para evadir la acción de estas terapias.
Monitorización genética del cáncer
El cáncer es una entidad dinámica, no estática, por lo que vigilar y controlar cómo se desarrolla, progresa o responde a un tratamiento es un elemento muy importante en la atención a los pacientes.
Los análisis genéticos pueden proporcionar una imagen de qué es lo que está ocurriendo en el momento en el que se toma la muestra. Capturan la variación genética del cáncer en un momento concreto.
Con los tumores que afectan a la sangre, esta información se puede tomar de forma directa a través de una muestra de sangre. Se puede monitorizar cómo evoluciona el cáncer (a partir de los cambios genéticos que se van produciendo en las células afectadas), si el tratamiento es efectivo (a través de la desaparición de las células tumorales con la mutación) o si aparecen resistencias.
En el caso de los tumores sólidos, la monitorización frecuente es más complicada debido a la necesidad de realizar biopsias invasivas. Además, en algunos casos no se puede obtener tejido. En este ámbito, las biopsias líquidas representan una oportunidad muy buena para poder obtener información en tiempo real y de forma menos invasiva.
Como hemos visto, la genética tiene un papel esencial en la aparición del cáncer. Gracias al desarrollo de las técnicas de análisis de ADN, se ha identificado muchas mutaciones y genes implicados en el cáncer, lo que ha hecho posible el abordaje del cáncer desde una perspectiva más cercana a sus causas.
Diagnóstico, asesoramiento genético, diseño de terapias específicas, desarrollo de biomarcadores… La genética tiene muchas aplicaciones en oncología. Aplicaciones que se traducen en mejoras para los pacientes.
Bibliografía «Genética en Cáncer»:
Instituto Nacional del Cáncer. https://www.cancer.gov/espanol
Observatorio global del cáncer. https://gco.iarc.fr/
Organización Mundial de la Salud. https://www.who.int/health-topics/cancer#tab=tab_2
Daver N, Schlenk RF, Russell NH, Levis MJ. Targeting FLT3 mutations in AML: review of current knowledge and evidence. Leukemia. 2019 Feb;33(2):299-312. doi: 10.1038/s41375-018-0357-9.
Campbell, P.J., Getz, G., Korbel, J.O. et al. Pan-cancer analysis of whole genomes. Nature 578, 82–93 (2020). https://doi.org/10.1038/s41586-020-1969-6
Nangalia J, Campbell PJ. Genome Sequencing during a Patient’s Journey through Cancer. N Engl J Med. 2019;381(22):2145-2156. doi:10.1056/NEJMra1910138
Alexandrov LB, Nik-Zainal S, Wedge DC, et al. Signatures of mutational processes in human cancer [published correction appears in Nature. 2013 Oct 10;502(7470):258. Imielinsk, Marcin [corrected to Imielinski, Marcin]]. Nature. 2013;500(7463):415-421. doi:10.1038/nature12477
Garber JE, Offit K. Hereditary cancer predisposition syndromes. J Clin Oncol. 2005;23(2):276-292. doi:10.1200/JCO.2005.10.042
Si te ha gustado este blog y quieres aprender más sobre Genética en Medicina, te interesan nuestras formaciones.



