Revista Genética Médica y Genómica
- Número 5
- Artículo de investigación
- 04/11/2020
Influencia de las alteraciones citogenéticas en el crecimiento de los cultivos de líquidos amnióticos
- Número 5
- Artículo de investigación
- 04/11/2020
David Arrabal Bazaga, Rosa María Lobo Valentín, América de León Rodríguez, Manuel González Sagrado
Servicio de Citogenética y Biología Molecular – Hospital Universitario Rio Hortega. Valladolid
Autor de correspondencia: darrabalb@saludcastillayleon.es
En el diagnóstico genético prenatal, el uso de los cultivos celulares para el estudio de los líquidos amnióticos permite detectar anomalías cromosómicas presentes en el feto, además de la posibilidad de ampliar a estudios genéticos moleculares usando el material genético extraído de las células cultivadas. Esta técnica invasiva se realiza a partir de la semana 16 de gestación, siendo este el momento idóneo por reducir el riesgo de pérdida fetal y conseguir una cantidad de amniocitos óptima para los cultivos celulares. Es por ello que el número, la viabilidad y la integridad genética de las células cultivadas de las muestras de líquidos amnióticos condicionan la calidad de los cultivos celulares, pudiendo alcanzar confluencias óptimas para la realización de estudios citogenéticos. Desde mediados del año 2000 se conoce que algunas anomalías citogenéticas adquiridas en cultivo proporcionan una ventaja adaptativa al crecimiento in vitro en células madre embrionarias humanas. En este trabajo retrospectivo se analizan 232 muestras de líquidos amnióticos de gestantes en el ejercicio 2019 en el Hospital Rio Hortega de Valladolid, en el que se estudia si las células presentes en los líquidos amnióticos con dotaciones cromosómicas patológicas muestran tiempos de cultivos diferentes de aquellas que tienen un resultado citogenético normal.
Tras la comparación de las muestras de líquidos amnióticos en función de su semana gestacional y dotación cromosómica, se determina que no existen diferencias significativas en los tiempos de cultivos cuando las células presentan alteraciones visibles mediante técnicas de citogenética convencional en amniocitos. Por ello se concluye que la tasa de división de este tipo celular con dotaciones cromosómicas patológicas compatibles con el desarrollo embrionario hasta el segundo trimestre no es diferente de aquellas que no las presentan. Así se deduce que las alteraciones que comprometen la integridad genética de una célula en cultivo y favorezcan o retrasen el crecimiento celular, no están relacionadas con las patologías halladas en el diagnóstico genético prenatal.
INFLUENCE OF CYTOGENETIC ABNORMALITIES ON THE GROWTH OF CELL CULTURE FROM AMNIOTIC FLUIDS
In prenatal genetic diagnosis, cell culture from amniotic fluids is widely used to detect chromosomal abnormalities present in the fetus. In addition, it entails the possibility to carry other genetic studies from the cell culture. Amniotic fluid sampling is an invasive technique ideally performed at week 16 of pregnancy to reduce the risk of fetal loss and to achieve an optimal amount of amniocytes for cell cultures. The number, the viability, and the genetic integrity of the cells from amniotic fluid samples determine the quality of the cell culture, and every single one is essential to reach optimal confluences for the performance of cytogenetic studies. Since the middle of the year 2000, it is known that certain cytogenetic abnormalities acquired in culture, provide an adaptative advantage to the in vitro growth of embrionic stem cells.
In this retrospective study, 232 samples of amniotic fluid from pregnant women in 2019 at the Hospital Rio Hortega in Valladolid are analyzed and the amniotic fluid cells with pathological chromosomal abnormalities are checked for different culture times than those with a normal cytogenetic result. Amniotic fluid samples were sorted according to their gestational week and chromosome dosage. No significant differences were found between culture times when the cells show visible alterations and normal cells, using conventional cytogenetic techniques in amniocytes. Therefore, these results suggest that the division rate of cells with pathological chromosomal abnormalities compatible with embryonic development until the second trimester is not different to that from cells without any pathological error.
Keywords: prenatal diagnosis, amniotic fluid, cytogenetics
INTRODUCCIÓN
Las anomalías cromosómicas tienen una prevalencia del 8% en la concepción y del 0,6% en el nacimiento, siendo la primera causa de pérdidas embrionarias y fetales del primer trimestre (Mora-Alférez, 2016). El diagnóstico prenatal agrupa todas aquellas acciones diagnósticas encaminadas a descubrir durante el embrazo un defecto congénito, entendiendo por tal toda anomalía del desarrollo morfológico, estructural, funcional o molecular presente al nacer (aunque pueda manifestarse más tarde), externa o interna, familiar o esporádica, hereditaria o no, única o múltiple (SEGO, 2013). Así, la detección temprana de anomalías cromosómicas resulta una necesidad en el control prenatal actual, estas técnicas se pueden clasificar en no invasivas e invasivas. En las primeras se utilizan técnicas biquímicas o ecográficas que nos permiten estudiar marcadores susceptibles de variación en aquellos embarazos con alteraciones morfológicas o genéticas, y técnicas basadas en el estudio del ADN fetal libre circulante en sangre materna (Figura 1), mientras que las pruebas invasivas son aquellas en las que se requiere invadir el espacio o entorno fetal para conseguir las muestras que se utilizarán para el estudio prenatal, aumentando el riesgo de interrupción del embarazo. Las pruebas invasivas en el diagnóstico genético prenatal son: amniocentesis, biopsia del corion y cordocentesis. Las indicaciones para estudio prenatal mediante técnicas invasivas para el análisis de anomalías cromosómicas son las siguientes:
- Padres portadores de reordenamiento cromosómico balanceado.
- Hijo previo con Síndrome de Down u otra anomalía cromosómica.
- Aborto espontáneo aneuploide en gestación previa.
- Historia familiar de malformaciones congénitas y otras alteraciones de etiología cromosómica.
- Hallazgos ultrasonográficos de malformaciones fetales asociadas con anomalías cromosómicas.
- Riesgo alto para anomalías cromosómicas calculado en la base de datos utilizando los marcadores biológicos, ecográficos y bioquímicos.
- Riesgo alto en Test Prenatal No Invasivo en ADN fetal circulante en sangre materna.
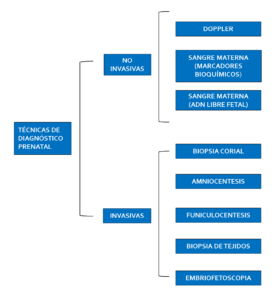
El momento gestacional para realizar las pruebas invasivas varía en función de la técnica. Para obtener un diagnóstico lo más temprano posible, entre las semanas 10 y 13 de embarazo se recurre a la biopsia corial. Esta puede ser a través del cuello del útero (transcervical) o a través de la pared abdominal (transabdominal). Existe un riesgo del 1% de rotura prematura de membrana e infección de líquido amniótico, pudiendo conllevar a la pérdida fetal. Esta técnica lleva asociada riesgos de contaminación materna por no haber tomado una muestra representativa, resultados no concluyentes por mosaicismos confinados a placenta o contaminación microbiana que causa el fallo del cultivo in vitro. Sin embargo, la amniocentesis como procedimiento de diagnóstico prenatal invasivo de segundo trimestre se realiza a partir de la semana 16 de gestación con un riesgo de pérdida fetal del 0,5%. No está indicado realizar amniocentesis antes de la semana 15 por la posibilidad de no existir fusión entre la membrana amniótica con el corion, donde el riesgo se triplica. Además existen otras complicaciones como la pérdida de líquido amniótico (0,3%), hemorragia placentaria, infección intraamniótica, hematoma de la pared abdominal o traumatismo fetal (Parra-Savedra, 2013). En definitiva, no está indicado realizar amniocentesis temprana antes de la semana 15, debido al aumento del riesgo de pérdida de fetal y escasez de células de origen embrionario obtenidos en el líquido amniótico.
Cultivos celulares de líquido amniótico
El éxito del cultivo del líquido amniótico se define por la presencia de células en crecimiento a las dos o tres semanas de la siembra. Esto ocurre en el 85% de los cultivos donde el pleomorfismo celular es un rasgo característico del líquido amniótico. Inicialmente, se observan células de gran tamaño con morfología poligonal, junto con células pequeñas con morfología redondeada, que son las que predominan. Esta situación cambia a los varios días de cultivo con la desaparición de las células poligonales y el crecimiento progresivo de otras células con morfología fibroblastoide. De dos a cuatro semanas, la línea de células de líquido amniótico se resuelve en un cultivo predominantemente fibroblástico, epiteloide o mixto (Hoyes, 1968).
La cantidad de células en una muestra es bastante baja antes de la semana 12 de gestación, aumentando progresivamente hacia la semana 15. Así, desde la semana 12 a la 20 hay un incremento del 50%, descendiendo a continuación (Hanneman, 1972). Por ello se considera que el momento adecuado para llevar a cabo una amniocentesis es alrededor de la semana 16, dado que existe la cantidad suficiente de líquido amniótico entre el amnios y el embrión, con una cantidad de células viables apropiadas para realizar el diagnóstico temprano (Therkelsen, 1972).
Integridad genética en cultivos celulares
En los años 90 se empezaron a describir las primeras anomalías cromosómicas en cultivos de células de origen embrionario y su correlación con los cultivos a largo plazo e ineficiencia para contribuir a las líneas germinales futuras. La mayoría de estos resultados pasaron desapercibidos y los investigadores siguieron cultivando sin verificar su integridad cromosómica porque, en parte, se habían definido como líneas celulares con un cariotipo normal (Liu, 1997).
Estas anomalías cromosómicas comenzaron a caracterizarse en humanos apareciendo de forma recurrente trisomías del par cromosómico 8 y 11, además de amplificaciones del brazo corto del cromosoma 20 (Lefort, 2009). Así se determinó que estas anomalías genéticas conferían una ventaja en el crecimiento de los cultivos, producto de una dosis desequilibrada de genes involucrados en el ciclo celular, regeneración o diferenciación (Cowan, 2004 y Maitra, 2005).
Es por ello que en este estudio se quiere determinar si los cultivos celulares procedentes de muestras de líquidos amnióticos con patología cromosómica presentan alteraciones en la tasa de división y, por consiguiente, tiempos de cultivos diferentes de aquellos con resultado citogenético normal.
MATERIALES Y MÉTODOS
En este estudio retrospectivo se analizó un total de 232 muestras de líquido amniótico de gestantes de edades comprendidas entre 14 y 46 años, correspondiente al ejercicio 2019 en el Hospital Universitario Rio Hortega de Valladolid, a pacientes de la sanidad pública de Castilla y León (Sacyl). Se analizaron los registros electrónicos y en papel de forma anónima de las muestras recogidas de líquido amniótico.
En todos los casos y siempre que fue posible, se establecieron 3 cultivos primarios (A, B, C) utilizando medios completos preparados (AmnioGrow Plus-Cytogen y Milieu Amnio Medium-Eurobio) congelados a temperaturas inferiores a –20ºC hasta su caducidad y estables de 12 a 15 días en nevera a 2-8ºC.
Para el cultivo y proliferación de los fibroblastos fetales presentes en el líquido amniótico se usaron 3 recipientes de cultivo de 25 cm2 de superficie con tapón de filtro ventilado. El proceso de incubación se realizó a 37ºC en una atmósfera de 5% de CO2 hasta la formación de nuevas colonias, aproximadamente de siete a nueve días tras su siembra. En el mantenimiento de los cultivos se realizaron procesos de cambio de medio cuando el pH viró y tripsinización cuando no había una distribución homogénea de las colonias en la superficie del recipiente de cultivo.
Los cultivos se levantaron con tripsina-EDTA al 0,05% para su procesamiento cuando alcanzaron una confluencia del 80% o de 4 a 6 células en metafases por campo (Figura 2). Posteriormente, en el proceso de obtención de metafases se utilizó Colcemid a una concentración de 10 mg/mL, inhibiendo la formación del huso acromático y consiguiendo parar los cromosomas en la fase de metafase, donde se encuentran más condensados. Para aumentar la permeabilidad de la membrana citoplasmática de los fibroblastos se usó un choque hipotónico con cloruro potásico a 0,075M para permitir la entrada de la solución de Carnoy, una mezcla de ácido acético y metanol en proporción 1/3 para la fijación de los cromosomas.

Una vez obtenidas las metafases, se extendieron en un portaobjetos de cristal, se envejeció durante un mínimo de 16 horas y se tiñó con la técnica de bandas GTG (patrón de bandas G) usando tripsina en PBS 1/20 (desde la solución madre a 0,25%) y el colorante Leishman. La tripsina es una enzima proteolítica que digiere de forma desigual las proteínas cromosómicas permitiendo que el colorante Leishman se una a secuencias ricas en A-T (bandas oscuras) y las ricas en G-C (bandas claras) de cada par de cromosomas.
En el análisis citogenético se estudiaron 20 metafases con una resolución de 400 a 450 bandas por caso, entre dos facultativos, con la captura automática de metafases mediante MetaSystem Metafer y usando el programa de gestión de imágenes Ikaros (versión 5.3, MetaSystems) (Figura 3). Se tuvo en cuenta la necesidad de estudiar dos cultivos independientes en el caso de que el sexo fetal fuera femenino, para verificar que las células del cultivo son de origen fetal y no materno y un único cultivo para fetos de sexo masculino o con patología cromosómica.

Análisis Estadístico
Se establecieron grupos de estudio en función de la semana gestacional, para que la comparación entre las muestras de los líquidos amnióticos fuera equitativa en términos de cantidad de células, ya que cuanto más avanzada sea la semana gestacional mayor número de amniocitos. Se excluyeron 6 muestras con semanas gestacionales mayores a la semana 24+0 por no formar un grupo lo suficientemente grande para el estudio comparativo. Por otro lado, además de las comparaciones por semanas gestacionales, se realizaron comparaciones atendiendo al sexo y patología cromosómica en cada grupo. Como se necesita un único cultivo para informar resultados de sexo masculino, y mínimo dos cultivos para sexo femenino, los tiempos de estos últimos pueden verse ligeramente prolongados por la necesidad de obtener una confluencia óptima para elaborar el cariotipo.
Para determinar el tiempo medio de cultivo de cada muestra, de los tres cultivos primarios (A, B, C) se realizó un promedio entre ellos, considerando la fecha de inicio el momento de la siembra y la final, la fecha en la que se levanta el cultivo por alcanzar un número de células en metafase suficiente para la realización del estudio citogenético.
En el análisis estadístico se utilizó la prueba t-Student para determinar las diferencias de promedios de las variables independientes de las muestras de líquido amniótico con resultado citogenético normal y patológico de cada grupo, teniendo en cuenta el sexo cromosómico. El nivel de significancia usado fue p<0,05. Los datos se analizaron con el programa estadístico Statistical Package for the Social Sciences (SPSS®, IBM).
.
RESULTADOS Y DISCUSIÓN
De las 232 muestras de líquidos amnióticos, 174 presentaron una dotación cromosómica normal (75%), 52 presentaron alteraciones citogenéticas (22,4%) y 6 no se pudieron informar por fallo en el cultivo (2,6%) (Tabla 1).
Tabla 1. Datos obtenidos de los resultados de los 232 líquidos amnióticos estudiados en el ejercicio 2019.
| Normal | 174 | Sexo | 46,XY | 88 |
| 46,XX | 86 | |||
| Patológico | 52 | Aneuploidías | S.Down (47,XX,+21) y (47,XY,+21) | 33 |
| S.Edwards (47,XX,+18) y (47,XY,+18) | 9 | |||
| S.Patau (47,XX,+13) y (47,XY,+13) | 2 | |||
| S.Klinefelter (47,XXY) | 2 | |||
| S.Turner (45,X) | 1 | |||
| Translocaciones | 46,XY,t(9;10)(q13;q26.1) | 1 | ||
| 46,XY,t(5;6)(p15;q23) | 1 | |||
| Cromosomas Derivados | 46,XY,der(Y) | 1 | ||
| 46,XY,del(21)(q221q22.3) | 1 | |||
| 46,XY,der(10) | 1 | |||
| No informable | 6 | – | – | 6 |
De los 52 líquidos amnióticos con resultados patológicos, 47 presentaron un número anómalo de cromosomas al cariotipo (aneuploides) siendo el más prevalente el Síndrome Down con 33 casos. También se obtuvieron 9 casos con síndrome de Edwards, 2 casos con síndrome de Patau, 2 con síndrome de Klinefelter y 1 con síndrome de Turner. Por otro lado, 2 casos presentaron reordenamientos cromosómicos y 3 casos mostraban cromosomas derivados.
La edad media de las gestantes fue de 35 años. De las 226 muestras de líquido amniótico que entraron en el estudio, 63 (27,9%) estaban entre las semanas gestacionales 15+0 -15+6 (Grupo 1), un total de 116 (51,3%) pertenecían a las semanas gestacionales 16+0-16+6 (Grupo 2) y 41 (18,14%) pertenecían a las semanas gestacionales comprendidas entre 17+0 y 22+6 (Grupo 3) (Tabla 2). Se consideró incluir en el mismo grupo a las muestras de la semana 17, 20 hasta la 22+6 por la disminución celular a partir de la semana 20, y por poder ser equitativos en términos de cantidad de células. Por otro lado, 6 muestras que se encontraban en el momento de su extracción en semanas gestacionales superiores a 24+0 no entraron en el estudio por no formar un grupo lo suficientemente grande para el estudio comparativo.
Tabla 2. Grupos de estudio por tiempo gestacional.
| Semanas gestacionales | Muestras de líquido amniótico |
| Grupo 1: 15+0 – 15+6 | 63 |
| Grupo 2: 16+0 – 16+6 | 116 |
| Grupo 3: 17+0 – 22+6 | 41 |
Analizando los estadísticos por grupo (Figura 4 y Tabla 3), se observa que en el grupo 1, el tiempo medio de cultivo de los líquidos amnióticos femenino sin patología fue de 19.16 días, mientras que en los patológicos fue de 19.22 con desviaciones típicas de 5.00 y 3.73 respectivamente. En el mismo grupo, el tiempo para los cultivos masculinos normales y patológicos fue, 17.71 y 18.37 días respectivamente con desviaciones estándar de 3.39 y 5.78.
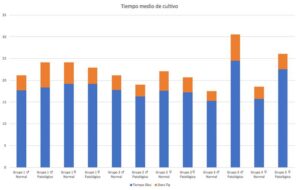
En el grupo 2, los cultivos femeninos normales tuvieron una media de 17.58 y los patológicos 17.23 con desviaciones típicas de 4.46 y 3.41, mientras que los masculinos normales y patológicos tuvieron tiempos de 17.75 y 16.28 días con desviaciones típicas de 3.39 y 2.72.
Por último, dado el grupo 3 presentaba un tamaño muestral pequeño de 41 muestras de líquidos amnióticos, se pudo observar una diferencia entre las medias de los tiempos de cultivos entre femenino normal y patológico, con 15.78 y 22.5 días, y desviaciones de 2.80 y 3.53 y en masculino normal y patológico, 15.26 y 24.50 días con desviaciones típicas de 2.23 y 6.05.
Al realizar la prueba de t-Student de cada comparación dentro de cada grupo observamos que en todos los casos el valor de p es mayor de 0.05, indicándonos que no hay diferencia significativa en los tiempos medios de cultivo entre los líquidos patológicos y normales.
En el grupo 3, el p-valor si resultó estar por debajo del nivel de significación 0.05, pero este resultado espurio viene dado por un número de muestras de líquidos amnióticos bajo, por lo que no se puede considerar que dicha comparación sea representativa. Además, como este grupo abarca un rango mayor de semanas gestacionales, el número de amniocitos en las muestras de líquido amniótico puede ser susceptible de ser diferente si lo comparamos con los otros dos grupos. Teniendo en cuenta como limitación del trabajo que el tamaño muestral no es demasiado elevado, se propone ampliar el estudio retrospectivo a otros ejercicios anuales, para obtener grupos con una n mayor.
Con este estudio se concluye que las anomalías cromosómicas visibles mediante técnicas de citogenética convencional en las muestras de líquido amniótico en los grupos estudiados no producen alteraciones en los tiempos de cultivo cuando las comparamos con muestras sin patologías. En los estudios con células madre embrionarias humanas sí existe una diferencia en las tasas de división en células aneuploides por haber una sobrexpresión de genes que inducen a la proliferación y crecimiento celular. Dichos genes se encuentran en los mismos pares cromosómicos donde se hallaron trisomías como la del par 8 o 11, confiriendo una ventaja adaptativa a las células en cultivo mediante un mecanismo de selección natural. Sin embargo, en el diagnóstico genético prenatal, los amniocitos ya presentaban alteraciones cromosómicas antes del cultivo y no fueron sometidos a una presión selectiva en el mantenimiento in vitro. Además, estas anomalías citogenéticas no ocurren en locis donde existen genes que favorezcan o perjudiquen el desarrollo normal del ciclo celular, pudiéndose explicar de este modo la ausencia de variación en las tasas de división celular.
Así, como el diagnóstico genético prenatal mediante prueba invasiva supone una situación de estrés, los hallazgos de este estudio nos permiten poder informar a las gestantes de que los tiempos de cultivos de los líquidos amnióticos no varían en función si es patológico o no, por lo que un retraso en la emisión de resultados no es indicativo de anomalía cromosómica.
AGRADECIMIENTOS
Agradecemos el trabajo diario del personal técnico de laboratorio por cuidar y tratar cada muestra de cada gestante con todo el cariño y cuidado. A la responsable de sección la Dra.Lobo Valentín, por la gestión, atención y organización de las pruebas en el diagnóstico genético prenatal y al resto de facultativos por el trabajo en la observación y búsqueda de anomalías citogenéticas.
También hacer mención al Dr. Gonzalez Sagrado, responsable de la unidad de Investigación del Hospital Rio Hortega de Valladolid, por su supervisión y apoyo en las estadísticas.
Bibliografía
Cowan CA. et al. Derivation of embryonic stem-cell lines from human blastocysts. N Engl J Med. 2004 Mar 25;350(13):1353-6. doi: 10.1056/NEJMsr040330.
Hahnemann N. Possibility of culturing foetal cells at early stages of pregnancy. Clin Genet. 1972;3(4):286-93. doi: 10.1111/j.1399-0004.1972.tb04278.x.
Hoyes AD. Ultrastructure of the cells of the amniotic fluid. J Obstet Gynaecol Br Commonw. 1968 Feb;75(2):164-71. doi: 10.1111/j.1471-0528.1968.tb02027.x.
Lefort N, Perrier AL, Laâbi Y, Varela C, Peschanski M. Human embryonic stem cells and genomic instability. Regen Med. 2009 Nov;4(6):899-909. doi: 10.2217/rme.09.63.
Liu X, et al. Trisomy eight in ES cells is a common potential problem in gene targeting and interferes with germ line transmission. Dev Dyn. 1997 May;209(1):85-91. doi: 10.1002/(SICI)1097-0177(199705)209:1<85::AID-AJA8>3.0.CO;2-T.
Maitra A. et al. Genomic alterations in cultured human embryonic stem cells. Nat Genet. 2005 Oct;37(10):1099-103. doi: 10.1038/ng1631.
Parra-Savedra M, et.al. Amniocentesis: Guía Práctica. Diagnóstico Prenatal. 2004. Ene-Jun. 5(1): 20-27.doi: 10.1016/j.diapre.2013.07.004
Mora-Alferez AP, et al. Anomalías cromosómicas en abortos espontáneos. Rev peru ginecol obst. 2016. 62(2).234-200
SEGO. Guía de práctica clínica: Diagnóstico prenatal de los defectos congénitos. Cribado de anomalías cromosómicas. Diagn Prenat. 2013 Aprl -Jun;24(2):57-72. doi: 10.1016/j.diapre.2012.06.013
Therkelsen A., et al. Prenatal diagnosis of chromosome abnormalities. Acta Paediatr Scand. 1972 Jul 1;61: 397-402, doi: 10.1111/j.1651-2227.1972.tb15854.x
Palabras Clave
diagnóstico genético prenatal, líquido amniótico, cultivo celular, citogenética
Contacto
¿Quieres publicar con nosotros? ¿Tienes dudas?
Contacta con nosotros de la manera que prefieras y te responderemos a la mayor brevedad.






