A finales de los años 80, mientras Madonna y Queen dominaban las listas de éxitos, en los laboratorios comenzaba a gestarse uno de los avances más prometedores en inmunoterapia: la creación de células T modificadas para atacar el cáncer (conocidas como células CAR-T). Aunque su verdadero potencial terapéutico no empezaría a explorarse completamente hasta los primeros años del 2000, hoy en día las terapias CAR-T se han consolidado como una revolución en el tratamiento del cáncer. ¿Quieres saber cómo funcionan? ¡Te lo explicamos!
Inmunoterapia: ¿qué son las células CAR-T y cómo funcionan?
Como sabéis, el sistema inmunitario es una compleja red de células, tejidos y órganos que actúa como defensa natural de nuestro cuerpo contra agentes potencialmente malignos. Por un lado, este sistema nos protege de virus, bacterias y otros microorganismos que acceden a nuestro cuerpo y, por otro, se encarga de eliminar las células propias que se han vuelto cancerosas. Sin embargo, en ciertos casos, las células tumorales adquieren mecanismos para escapar del sistema inmunitario.
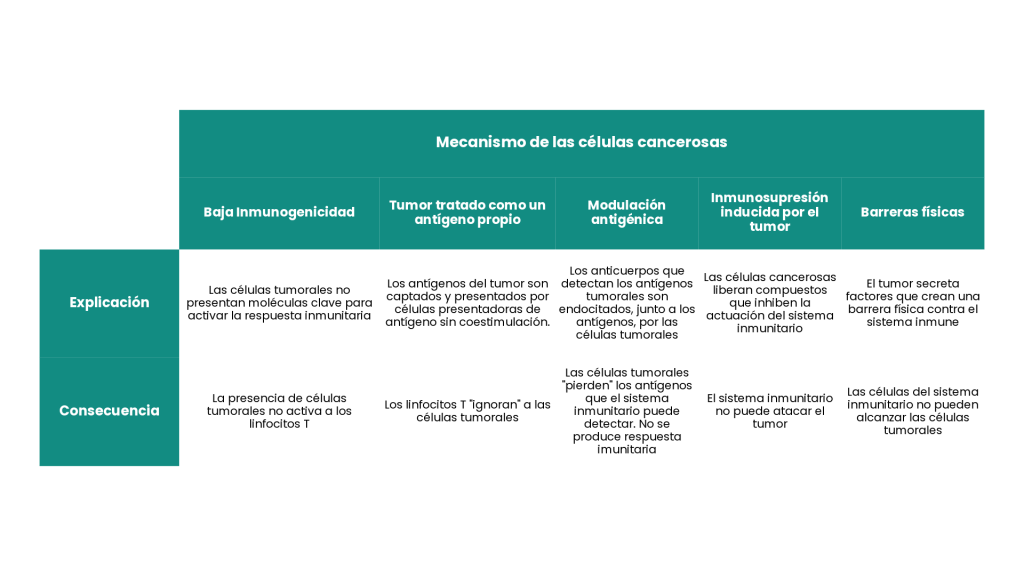
De este punto parte la base de las inmunoterapias, un tipo de terapias contra el cáncer que buscan ayudar al propio sistema inmunitario del paciente a reconocer y atacar a las células cancerosas. Las terapias de células CAR-T son una de estas inmunoterapias.
Las células CAR-T son, en esencia, linfocitos T de una persona que han sido modificados genéticamente para que expresen receptores específicos capaces de reconocer los antígenos de un tumor. Al administrar las células T modificadas al paciente, estas son capaces de reconocer a las células cancerosas y activar una potente respuesta inmunitaria (inflamación e inducción de la muerte celular) que las destruye.
Ventajas y limitaciones
Las características propias de las células CAR-T hacen que estas terapias sean excepcionalmente interesantes en ciertos casos. Y es que suponen algunas ventajas frente a otros tipos de terapias.
En primer lugar, se trata de terapias dirigidas y personalizadas, creadas a partir de las células del propio paciente. Esto hace que sean, por un lado, muy específicas, ya que han sido diseñadas para reconocer antígenos del tumor del paciente y, por otro, que tengan un riesgo de rechazo mínimo por parte del paciente.
En segundo lugar, se trata de terapias de administración única (generalmente) y altamente persistentes, cuyo efecto puede perdurar durante meses. Esto puede prevenir la aparición de nuevos tumores en el paciente, incluso tras una sola dosis.
Por último, las inmunoterapias de células CAR-T han demostrado tener alta tasa de respuesta, especialmente en pacientes con cánceres hematológicos resistentes a otros tratamientos convencionales.
Sin embargo, no es oro todo lo que reluce. Pese a sus ventajas, las terapias CAR-T todavía son muy costosas y requieren de centros especializados, lo que limita bastante su disponibilidad para el tratamiento de los pacientes oncológicos. Además, actualmente están bastante limitadas a pacientes con cánceres hematológicos.
Aunque se ha demostrado que su utilización en ciertos tipos de tumores sólidos puede evitar la proliferación del cáncer durante más de 18 años, los tumores sólidos siguen siendo un reto. Esto es principalmente debido a la falta de antígenos específicos, la inmunosupresión local del microambiente tumoral y las barreras físicas para la infiltración de las células CAR‑T. Diferentes grupos de investigadores están trabajando para identificar formas de lograr que las inmunoterapias CAR-T logren superar las barreras que supone su utilización en este tipo de tumores.
Si quieres profundizar más en cómo las terapias basadas en células CAR-T pueden mejorar el pronóstico de los pacientes oncológicos, te interesa nuestro Experto Universitario en Oncogenética. Este programa, acreditado por la Universidad Politécnica de Valencia, te servirá no sólo para profundizar en este tipo de inmunoterapias, sino que también te actualizará en la utilización de las últimas terapias avanzadas para el tratamiento del cáncer.
¿Cómo se hace una terapia CAR-T?
La fabricación de una terapia CAR-T es un proceso complejo donde cada paso está diseñado para crear un “ejército” de linfocitos capaces de reconocer y eliminar de forma específica las células tumorales del paciente. A continuación, veremos los pasos que siguen este tipo de terapias:
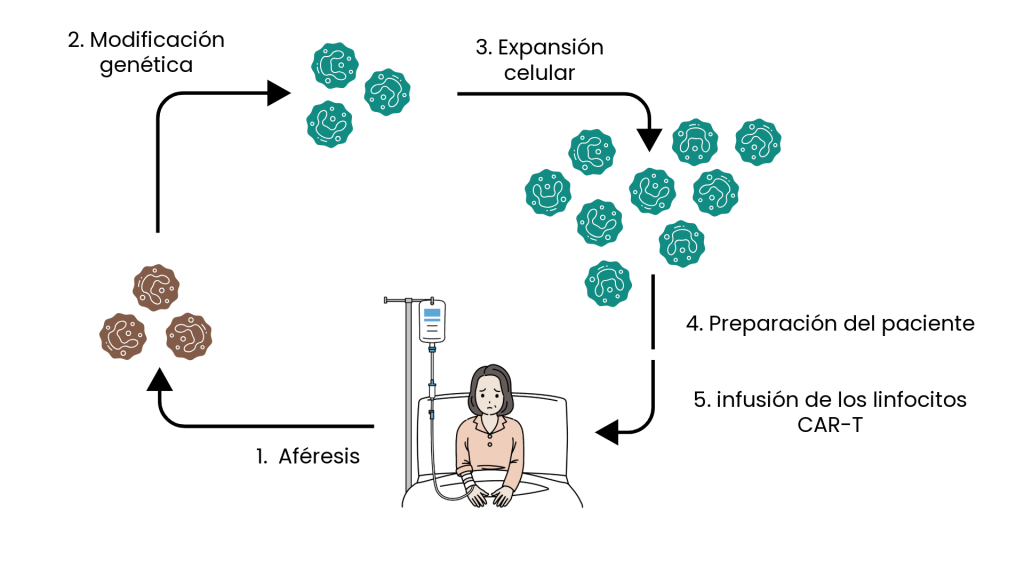
1. Aféresis: El primer paso es la recolección de los linfocitos T de la sangre del paciente. Este paso se conoce como aféresis.
2. Modificación genética: una vez aisladas y purificadas, las células T se modifican genéticamente. Concretamente, se les introduce la información genética necesaria para sintetizar un receptor de antígeno quimérico (lo que se abrevia como CAR), que habrá sido diseñado contra un antígeno presente en la superficie de las células tumorales (por ejemplo, las proteínas CD19 y BCMA).
3. Expansión celular: una vez modificadas, se cultivan los linfocitos CAR-T, para que se multipliquen y sean suficientes para tener efecto terapéutico. Este proceso puede tardar entre 7 y 14 días.
4. Preparación del paciente: antes de la introducción de las células CAR-T, el paciente suele recibir una quimioterapia leve que promueve la reducción del resto de linfocitos en su sangre. Este paso crea un ambiente inmunológico favorable para la actuación de las células T modificadas.
5. Infusión de los linfocitos CAR-T: se devuelven las células modificadas al paciente, donde podrán ejercer su acción antitumoral.
Terapias aprobadas
Aunque las terapias CAR-T parecen algo futurista, son una realidad aprobada por diferentes organismos referentes en salud y que se está aplicando ahora mismo en la clínica.
La primera terapia aprobada de este tipo fue Kymriah (tisagenlecleucel), que fue aprobada inicialmente por la FDA (U.S. Food and Drug Administration) en 2017 y posteriormente financiada dentro del marco del Sistema Nacional de Salud Español desde 2019. Esta terapia basada en células CAR-T está indicada para pacientes con leucemia linfoblástica de células B menores de 25 años y pacientes adultos con recaída de linfoma difuso de células B grandes.
A la aprobación de Kymriah le siguieron la aprobación de Yescarta (axicabtagene ciloleucel), en 2017, la del idecabtagene vicleucel en 2021 y la del obecabtagene autoleucel en 2024, entre muchas otras. Todas estas terapias están indicadas para tratamientos de ciertos tumores hematológicos, como la leucemia linfoblástica aguda o el mieloma múltiple.
Además de las terapias CAR-T elaboradas por la industria farmacéutica y aprobadas por organismos oficiales, existen terapias CAR-T denominadas como “terapias académicas”. Estas terapias, que se realizan en hospitales públicos, pueden ser una oportunidad de ampliación y mejora de los tratamientos fuera del amparo de la industria farmacéutica. Uno de los ejemplos más utilizados para hablar de este tipo de terapias académicas es ARI-0001 del Hospital Clínic de Barcelona.
A continuación, os facilitamos el listado de terapias avanzadas, entre las que se encuentran las terapias CAR-T (industriales y académicas), que están ofertadas dentro del marco del Sistema Nacional de Salud Español:
https://www.sanidad.gob.es/areas/farmacia/infoMedicamentos/terapiasAvanzadas/home.htm
Terapias CAR-T en enfermedades no oncológicas
Las terapias con células CAR-T han demostrado su utilidad principalmente en enfermedades oncológicas. No obstante, también tienen potencial en el tratamiento de pacientes con otros tipos de enfermedades, como las enfermedades autoinmunes.
Por ejemplo, un estudio de 2022 demostró que la utilización de linfocitos CAR-T puede mejorar la salud de pacientes con lupus eritematoso sistémico resistente. Otros estudios han planteado el reposicionamiento de terapias CAR-T para el tratamiento de la miastenia gravis.

