 Instituto de Neurociencias de Alicante, Universidad Miguel Hernández de Elche-CSIC
Instituto de Neurociencias de Alicante, Universidad Miguel Hernández de Elche-CSIC
- En el Instituto de Neurociencias de Alicante, centro mixto de la Universidad Miguel Hernández de Elche y el CSIC, el grupo del doctor Hugo Cabedo ha descubierto cómo inducen los nervios periféricos la reparación de la capa de mielina para que se vuelva restablecerse correctamente la comunicación después de una lesión.
- Este hallazgo puede aportar pistas para lograr el objetivo largamente perseguido de reparar la médula espinal.
A diferencia de lo que ocurre con la médula espinal después de una lesión, los nervios periféricos, que inervan los músculos y hacen posible su movimiento, tienen una capacidad significativa de “autorrepararse”. Después de una lesión, la parte final del nervio experimenta un proceso biológico especializado encaminado a crear las condiciones adecuadas para su regeneración. Sin embargo, es un proceso lento que en ocasiones puede fallar y dejar secuelas.
Averiguar cómo se lleva a cabo esta reparación es importante para acortar la recuperación e intervenir cuando esta no se produce adecuadamente. Además, podría contribuir a entender qué falla en el sistema nervioso central y lograr el objetivo largamente perseguido de reparar la médula espinal después de una lesión.
Unas células muy especiales
La reparación espontánea de los nervios periféricos es posible gracias a un tipo especial de células, llamadas de Schwann, que envuelven las fibras nerviosas con una capa aislante, la mielina. Esta capa grasa protege los nervios y aumenta la velocidad de transmisión de los impulsos nerviosos.
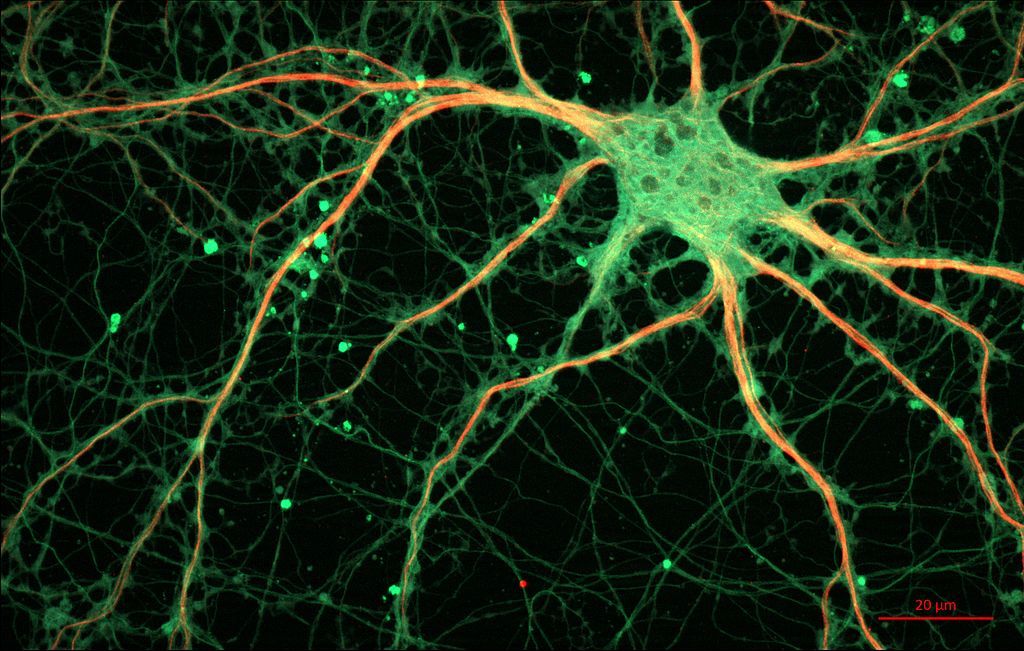
En el Instituto de Neurociencias de Alicante, centro mixto de la Universidad Miguel Hernández de Elche y el CSIC, el grupo del doctor Hugo Cabedo acaba de descubrir precisamente cómo induce el nervio (axón) la producción de la capa de mielina por parte de la célula de Schwann, para que se vuelva restablecerse correctamente la comunicación después de una lesión.
“En el sistema nervioso periférico las células de Schwann tienen un papel muy importante a través de un proceso muy regulado de diferenciación y desdiferenciación, una característica que no tiene ninguna otra célula del sistema nervioso. Esto las hace muy plásticas y permite que pasen de un estado en el que producen mielina a otro, menos diferenciado, en el contribuyen a reparar el nervio dañado”, explica el doctor Cabedo.
Cuando sufrimos una lesión en un nervio periférico, como el que va desde la médula a los dedos de la mano o el pie, las células de Schwan pierden temporalmente la capacidad para formar mielina y retroceden a un estadio anterior del desarrollo muy primitivo. El objetivo de esta transformación es ayudar al nervio a regenerarse y a crecer de nuevo para llegar a los tejidos diana. Una vez reparado el nervio, la célula recupera de nuevo su capacidad de producir mielina para recubrir el nervio con la capa aislante y permitir la correcta transmisión de los impulsos nerviosos.
El mensajero que transmite la orden
En este proceso, como ha averiguado el grupo del doctor Cabedo, tiene un papel fundamental un mensajero químico denominado AMP cíclico. “El AMP cíclico envía al núcleo de las células de Schwann a una proteína denominada Histona Deacetilasa 4 que, una vez reparado el nervio, pone en marcha de nuevo la mielinización. Esto se consigue al inactivar al gen c-Jun, que en condiciones normales bloquea la producción de mielina. La inactivación del gen c-Jun es necesaria y suficiente para activar a los genes productores de mielina para recubrir el nervio ya regenerado”.
Este proceso hace posible la reparación espontánea de un nervio o en algunos casos reimplantar un dedo amputado, por ejemplo. “Si te cortas un nervio periférico y el cirujano lo cose adecuadamente se acaba regenerando. Aunque los nervios en su parte terminal degeneran, las células de Schwann, que se mantienen, se convierten ahora en reparadoras y ayudan al nervio a alcanzar de nuevo los tejidos diana. Una vez que el nervio ha alcanzado su destino, la célula de Schwann se convierte de nuevo en productora de mielina para añadir la capa aislante. Desgraciadamente en nervios de cierta entidad, la regeneración nerviosa y la evolución clínica asociada no es completa, quedando secuelas de por vida”, explica el doctor Cabedo.
Este hallazgo puede facilitar el tratamiento de lesiones de los nervios periféricos, como ocurre en los accidentes de tráfico. “Este es el siguiente paso de nuestra investigación”, resalta este experto.
Enfermedades que deterioran la mielina
El trabajo del doctor Cabedo puede ser importante para mejorar el tratamiento de algunas enfermedades en las que la mielina se deteriora, como la de Charcot Marie Tooth, de origen genético, en la que “las células de Schwann pierden la capacidad de mielinización y aparecen problemas de coordinación en las piernas, con tropiezos, caídas, atrofia de los músculos y serias dificultades para caminar”, explica el doctor Cabedo.
También puede ser relevante en el síndrome de Guillain-Barré, trastorno neurológico que ocurre después de una infección, en el que de forma repentina el sistema inmune ataca a las células de Schwann. Esto tiene consecuencias muy graves, como la pérdida de movilidad y la capacidad de percibir estímulos externos. Además, se produce un déficit respiratorio progresivo que puede llevar a la muerte por asfixia en uno o dos días si no se actúa con rapidez para proporcionar respiración asistida en una unidad de cuidados intensivos.
“La investigación que estamos llevando a cabo puede ayudar también a diseñar terapias que mejoren la remielinización tras el ataque autoinmune que tiene lugar en el síndrome de Guillain-Barré”, resalta el doctor Cabedo.
Otros estudios sugieren que la mielina también está alterada en la enfermedad de Alzheimer y en la esquizofrenia. “Es por lo tanto previsible que nuevos trabajos orientados a entender cómo se forma la mielina puedan ayudar a esclarecer las causas estas enfermedades”, adelanta el doctor Cabedo.
Referencia: Gomis-Coloma C, et al. Class IIa histone deacetylases link cAMP signaling to the myelin transcriptional program of Schwann cells. J Cell Biol. 2018 Apr 2;217(4):1249-1268. doi: http://dx.doi.org/10.1083/jcb.201611150

