Las acil-CoA sintetasas de cadena larga (ACSL1, 3, 4, 5, 6) activan los ácidos grasos uniéndolos a Coenzima A (CoA) y generando ácidos grasos-CoA. Esta actividad es común a todas estas enzimas pero se especializan por la compartimentación celular. La ACSL5 está principalmente en mitocondria, aunque también en el núcleo y retículo endoplásmico. Estos productos ácidos grasos-CoA son el paso inicial en su metabolismo. Una vez activados, participan en el crecimiento celular, la diferenciación y la regulación de energía, por lo que cualquier defecto genético-molecular de este sistema puede contribuir a muchas enfermedades (Soupene y Kuypers, 2008).
Por ejemplo, el exceso de metabolismo de ácidos grasos se ha asociado cada vez más a trastornos metabólicos y carcinogénesis (Tang et al, 2018). La ACSL5 participa activamente en numerosos tipos de cáncer: en unos por el aumento de su expresión y en otros por la disminución, y en algunos de ellos tiene un valor pronóstico potencial. A diferencia de otras ACSLs, la ACSL5 está disminuida en carcinomas colorrectales, mama, vejiga y páncreas. Sin embargo, está sobreexpresada en glioma y se considera un posible objetivo terapéutico. Además, el ARN de la quimera ACSL5 con el receptor del factor de crecimiento de fibroblastos (FGFR2) hace que las células clínicas del cáncer gástrico sean más resistentes al tratamiento con inhibidores de la FGFR.
En un estudio anterior (Matesanz et al, 2016) identificamos una variante genética intrónica, rs2256368:A>G, cuyo alelo G promueve la pérdida del exón 20 en hasta el 43% de las transcripciones de ACSL5, y se asoció a migraña por su desequilibrio de ligamiento total con un polimorfismo de un GWAS (Estudio de asociación de genoma completo, en sus siglas en inglés) de dicha enfermedad (Anttila et al, 2013).
En esta reseña comentamos el estudio funcional de este splicing alternativo en ACSL5 que hemos publicado hace unos días (Pérez-Núñez et al, 2019). Brevemente, comparamos la expresión del ARN y proteína carente del exón 20 (Spl ACSL5) con el del ARN y proteína completa (NSpl ACSL5), en células linfoblastoides (LCLs) del proyecto 1000 Genomas (Fig. A), una colección de la que podemos elegir células con cada uno de los genotipos de la variante rs2256368:A>G. Alternativamente se transfectaron diferentes líneas celulares con las dos isoformas, y analizamos los niveles de expresión de ARN y proteína (Fig. B y C).
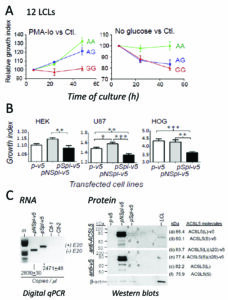
El efecto de la expresión sobre la viabilidad celular de LCLs se realizó en condiciones de cultivo que obligaban a las células a metabolizar ácidos grasos de cadena larga, bien por estimulación del crecimiento celular con PMA-Io (acetato de miristato de forbol, PMA, más ionomicina -Io) o en cultivos prácticamente sin glucosa (No glucose) (Fig. A). Encontramos que las líneas celulares linfoblastoides del Proyecto 1000 Genomas, que llevan alelo G (productoras de splicing), mostraron una expresión reducida de la proteína ACSL5 total, debido a una traducción ineficiente de los transcritos Spl. El crecimiento de estas células (GG) fue especialmente afectado en cultivos con PMA-Io o medio sin glucosa comparado con los cultivos en medio normal sin tratar.
La transfección de plásmidos con las dos isoformas de ACSL5 en células HEK239T (riñón), U87 (astroglioma) y HOG (oligodendroglioma) mostró que la proteína ACSL5 Spl es el factor causal de la inhibición del crecimiento celular (Fig.C), a pesar de que la expresión de la proteína ACSL5 Spl fue muy reducida (Fig. B). Esta actividad es opuesta a la que tiene la isoforma ACSL5 NSpl, que participa del crecimiento celular.
Los diferentes portadores alélicos (G o A) de esta variante genética pueden producir grandes diferencias en la expresión de las dos isoformas, la ACSL5 Spl y la ACSL5 NSpl, considerándose una eQTL (expression quantitative trait locus) y, también, una pQTL (protein quantitative trait locus), por lo que puede aumentar la variabilidad fenotípica y la susceptibilidad a enfermedades complejas en poblaciones humanas (Park et al, 2018).
Los resultados indican que la variante rs2256368:A> G puede predecir una actividad inhibidora del crecimiento, causada por la isoforma Spl de la proteína, en oposición a la actividad promotora del crecimiento de la variante genética ACSL5 NSpl. Este efecto inhibidor del crecimiento lo interpretamos como perjudicial para la célula y estaría en buena parte neutralizado (Battle et al, 2015) por algún mecanismo celular que inhibe considerablemente la traducción del ARN Spl (Wu et al, 2013), posiblemente basado en la acción de micro-ARNs que neutralizarían los efectos tóxicos (Baek et al, 2008). No es un problema de cantidad de ARN ya que expresa cantidades similares para ambas isoformas. La comprensión profunda de su funcionamiento podría tener aplicación en enfermedades metabólicas y cáncer, y posiblemente en otras enfermedades (Tang et al, 2018; Zhang et al, 2015)
Como marcador, esta variante genética puede ser útil para predecir la presencia de un ARN de ACSL5 Spl, además de la proteína Spl correspondiente. Su bajo nivel de expresión parece atenuar su fuerte efecto inhibidor del crecimiento. La ACSL5 generalmente disminuye en aquellos tipos de cáncer donde ACSL1 y ACSL4 están altamente expresados, por lo que sería interesante profundizar nuestra comprensión de los mecanismos implicados en este splicing alternativo, porque parece que entre ambas isoformas existe una posible respuesta contra los dos tipos de células cancerosas, las que disminuyen la ACSL5 y las que lo regulan aumentándola. Todos estos resultados pueden ser relevantes en condiciones que involucran el metabolismo de los lípidos, disfunción mitocondrial y carcinogénesis.
Referencia:
Anttila V, et al. Genome-wide meta-analysis identifies new susceptibility loci for migraine. Nat Genet. 2013 Aug;45(8):912-917. doi: http://dx.doi.org/10.1038/ng.2676
Baek D, et al. The impact of microRNAs on protein output. Nature. 2008 Sep 4;455(7209):64-71. doi: http://dx.doi.org/10.1038/nature07242
Battle A, et al. Genomic variation. Impact of regulatory variation from RNA to protein. Science. 2015 Feb 6;347(6222):664-7. doi: http://dx.doi.org/10.1126/science.1260793
Matesanz F, et al. A splice variant in the ACSL5 gene relates migraine with fatty acid activation in mitochondria. Eur J Hum Genet. 2016 Nov;24(11):1572-1577. doi: http://dx.doi.org/10.1038/ejhg.2016.54
Park E, et al. The Expanding Landscape of Alternative Splicing Variation in Human Populations. Am J Hum Genet. 2018 Jan 4;102(1):11-26. doi: http://dx.doi.org/10.1016/j.ajhg.2017.11.002
Pérez-Núñez I, et al. Splice-site variant in ACSL5: a marker promoting opposing effect on cell viability and protein expression. Eur J Hum Genet. 2019 May 3. doi: http://dx.doi.org/10.1038/s41431-019-0414-5
Soupene E, Kuypers FA. Mammalian long-chain acyl-CoA synthetases. Exp Biol Med (Maywood). 2008 May;233(5):507-21. doi: http://dx.doi.org/10.3181/0710-MR-287
Tang Y, et al. Fatty acid activation in carcinogenesis and cancer development: Essential roles of long-chain acyl-CoA synthetases. Oncol Lett. 2018 Aug;16(2):1390-1396. doi: http://dx.doi.org/10.3892/ol.2018.8843
Wu L, et al. Variation and genetic control of protein abundance in humans. Nature. 2013 Jul 4;499(7456):79-82. doi: http://dx.doi.org/10.1038/nature12223
Zhang X, et al. Identification of common genetic variants controlling transcript isoform variation in human whole blood. Nat Genet. 2015 Apr;47(4):345-52. doi: http://dx.doi.org/10.1038/ng.3220
Si te ha gustado esta noticia y quieres aprender más sobre Genética en la Práctica Clínica, quizás te interese nuestro curso “Genética para Médicos y Profesionales Sanitarios”. Tienes más información sobre el curso aquí.


