Jose F. Moruno-Manchon, Louise McCullough y Andrey S. Tsvetkov
Departamento de Neurología y el Departamento de Neurobiología y Anatomía, University of Texas McGovern Medical School at Houston, TX 77030, USA
La doble hélice de DNA es la conformación secundaria predominante en la que el DNA se organiza. Sin embargo, existen otros tipos de conformación que ocurren en el DNA, como el cuádruplex de guanina (G4). Un G4 resulta de la superposición de varios cuartetos de guanina (G) en la que cada cuarteto de G es una estructura cíclica y plana formada por cuatro Gs. Los G4s son importantes para la recombinación del DNA, replicación, mantenimiento de telómeros y la regulación de la transcripción (Hansel-Hertsch et al. 2017). Varias helicasas y diferentes factores de transcripción se unen a los G4s y pueden regular positiva o negativamente la expresión génica.
Los G4s pueden ser estabilizados por la oxidación de las Gs. El envejecimiento del cerebro humano está asociado con una mayor oxidación de Gs en aquellos genes cuya expresión es suprimida. Esto sugiere que existe una mayor formación de G4s en el cerebro envejecido y que esto podría alterar la expresión génica en las células del cerebro. Sin embargo, no se conoce aún cómo la formación de los G4s puede alterar la funcionalidad del cerebro.
Los G4s han sido asociados como reguladores negativos en la patogénesis de enfermedades neurodegenerativas como el Síndrome Frágil X, demencia frontotemporal y la esclerosis lateral amiotrófica (Maizels 2015). Anteriormente, descubrimos que la estabilización de los G4s daña el DNA, reduce la expresión de Brca1 (un gen implicado en la reparación del DNA) e induce la muerte celular en neuronas primarias cultivadas de rata (Moruno-Manchon et al. 2017).
Recientemente, nos planteamos si los G4s también regulan la expresión de genes implicados en la autofagia. La autofagia es un proceso de auto-limpieza de las células que elimina agregados de proteínas, orgánulos dañados y parásitos. Se inicia con la formación y maduración de vesículas de doble membrana que secuestran porciones de citoplasma y que finalmente se fusionan con lisosomas para la degradación final. El fallo de la autofagia y con ello, la acumulación de agregados, interfiere en múltiples funciones neuronales (Galluzzi et al. 2017). Así, las neuronas, al ser células post-mitóticas, son especialmente dependientes de la autofagia porque no pueden diluir los productos tóxicos por división celular. El envejecimiento del cerebro está asociado a una reducción de la autofagia y la expresión de varios genes relacionados con la autofagia se ve reducida durante el envejecimiento.
Usando una herramienta bioinformática, comprobamos que la mayoría de los genes que participan en la maquinaria de la autofagia contienen secuencias que potencialmente pueden formar G4s en el genoma de ratones, ratas y humanos. Nos llamó especialmente la atención Atg7 debido al gran número de posibles G4s que pueden formarse en su secuencia. ATG7 es crítica para el inicio de la autofagia. Los ratones deficientes en Atg7 mueren un día después de nacer, lo que refleja la importancia de este gen. Los niveles de ATG7 están reducidos en los cerebros de humanos de avanzada edad comparados con los cerebros de humanos más jóvenes. Sin embargo, no se conocen los mecanismos que regulan la expresión de Atg7.
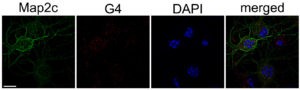
En nuestro estudio, comprobamos que la expresión de Atg7 y los niveles de ATG7 se redujeron en las neuronas primarias cultivadas de embriones de rata que fueron tratadas con estabilizadores de G4 en comparación con las células control. En colaboración con David Monchaud del Instituto de Química Molecular de la Universidad de Borgoña (ICMUB, Dijon, Francia), identificamos la secuencia de Gs en el gen Atg7 con mayor probabilidad de formar G4s (Atg7-32). Usando las técnicas dicroísmo circular, espectro de diferencia térmica y resonancia magnética nuclear confirmamos que dicha secuencia se pliega en G4s.
Para confirmar que la formación de G4s ocurre en neuronas en cultivo, utilizamos un fluoróforo específico de G4, N-TASQ (Yang et al. 2017). Las neuronas tratadas con los estabilizadores de G4 mostraron un significativo aumento de la fluorescencia de N-TASQ comparado con las células control, indicando que los G4s sí se forman en neuronas. Luego, por medio de Western blots, microscopía de fluorescencia y experimentos de pulso y caza óptico, confirmamos que un estabilizador de G4 (piridostatina, PDS) redujo la progresión de la autofagia neuronal. Además, comprobamos que la expresión ectópica de Atg7 en neuronas tratadas con PDS mitigó la deficiencia de la autofagia inducida por la estabilización de G4.
Debido a que la oxidación de Gs promueve la estabilización de G4s y que en los cerebros envejecidos ocurre una mayor tasa de oxidación de DNA, pensamos que el tratamiento de ratones con PDS podría acelerar los síntomas de envejecimiento. Para ello inyectamos PDS en ratones wild-type y analizamos sus funciones cognitivas. Encontramos que los ratones tratados con PDS mostraron déficits en reconocer nuevos objetos comparado con los ratones control. Además, los cerebros de los ratones tratados con PDS contenían mayores depósitos de lipofuscina, cúmulos de proteína oxidada que normalmente aparecen en tejidos de individuos envejecidos. Estos datos sugieren que la estabilización de los G4s reproduce algunas características del envejecimiento.
Para confirmar que existe cierto paralelismo entre el envejecimiento y la estabilización de G4s, analizamos la expresión de Atg7 y el contenido de estructuras G4s en los cerebros de ratones jóvenes y viejos. Encontramos una menor expresión de Atg7 y mayores niveles de G4s en los cerebros de los ratones viejos comparado con el de los jóvenes.
Una pregunta más que nos planteamos fue si podríamos prevenir los fenotipos inducidos por la estabilización de los G4 en neuronas cultivadas. Existen unas 20 helicasas que desenrollan los G4s. Pif1 es una de las más potentes y mejor estudiadas (Paeschke et al. 2013). Co-transfectamos neuronas primarias con un plásmido que codifica para Pif1 fusionado con GFP (Pif1-GFP) y con un plásmido que codifica para una proteína roja, mApple, para visualizar la morfología neuronal. Las neuronas fueron tratadas con un vehículo como control o con PDS. Observamos que la muerte neuronal se redujo en aquellas células expresaban Pif1-GFP y tratadas con PDS comparadas con aquellas co-transfectadas con un plásmido control y tratadas con PDS. Además, en experimentos de pulso y caza ópticos demostramos que la expresión ectópica de Pif1 mitigó los defectos en la autofagia inducidos por PDS.
En resumen, nuestros datos demuestran que la expresión de Atg7 está regulada por la formación de G4s en el DNA en neuronas y que afecta a la viabilidad y autofagia neuronal. Además, la acción de helicasas como Pif1 puede revertir los efectos de la estabilización de G4 en neuronas. Este estudio revela un nuevo mecanismo de regulación de la autofagia, la cual es un objeto de interés para desarrollar estrategias para mitigar o frenar el envejecimiento neuronal y la neurodegeneración.
Referencia del trabajo
Moruno-Manchon JF, et al. A small molecule G-quadruplex stabilizer reveals a novel pathway of autophagy regulation in neurons. eLife, 2020;9:e52283 doi: http://dx.doi.org/10.7554/eLife.52283
Referencias
Galluzzi, L., et al. Molecular definitions of autophagy and related processes. EMBO J. 2017 Jul 3;36(13):1811-1836. doi: http://dx.doi.org/10.15252/embj.201796697
Hansel-Hertsch, R., et al. DNA G-quadruplexes in the human genome: detection, functions and therapeutic potential. Nat Rev Mol Cell Biol. 2017 May;18(5):279-284. doi: http://dx.doi.org/10.1038/nrm.2017.3
Maizels N. G4-associated human diseases. EMBO Rep. 2015 Aug;16(8):910-22. doi: http://dx.doi.org/10.15252/embr.201540607
Moruno-Manchon JF, et al. The G-quadruplex DNA stabilizing drug pyridostatin promotes DNA damage and downregulates transcription of Brca1 in neurons. Aging (Albany NY). 2017 Sep 12;9(9):1957-1970. doi: http://dx.doi.org/10.18632/aging.101282
Paeschke K, et al. Pif1 family helicases suppress genome instability at G-quadruplex motifs. Nature. 2013 May 23;497(7450):458-62. doi: http://dx.doi.org/10.1038/nature12149.
Yang SY, et al. Real-time and quantitative fluorescent live-cell imaging with quadruplex-specific red-edge probe (G4-REP). Biochim Biophys Acta Gen Subj. 2017 May;1861(5 Pt B):1312-1320. doi: http://dx.doi.org/10.1016/j.bbagen.2016.11.046
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos. Tienes más información aquí.



