Chiara Ambrogio, Mariano Barbacid y David Santamaría
Laboratorio de Oncología Experimental, Centro Nacional de Investigaciones Oncológicas (CNIO), Madrid.
Mutaciones activadoras del proto-oncogén K-RAS son las causantes del subtipo mayoritario de adenocarcinoma de pulmón humano. Además de presentar una mayor prevalencia es el subtipo con peor pronóstico, debido entre otras causas a la ausencia de terapias específicas para su tratamiento en la clínica, razón por la cual continúa siendo tratado exclusivamente con quimioterapia. El desarrollo de nuevas estrategias terapéuticas es por tanto un objetivo primordial.
En los últimos años un nuevo aspecto de la biología tumoral está empezando a influir nuestra forma de entender y tratar el cáncer. Se trata de la heterogeneidad intratumoral, un fenómeno conocido desde hace tiempo desde un punto de vista exclusivamente histológico. La reciente implementación de técnicas sensibles de secuenciación masiva han permitido demostrar que durante su desarrollo, los tumores evolucionan generando subclones con diferentes perfiles genéticos, epigenéticos y transcripcionales. Esta diversidad hace que los tumores sean entidades dinámicas y adaptativas contribuyendo en gran medida a la aparición de resistencia terapéutica y eventualmente siendo causante de las recidivas tumorales (McGranahan y Swanton, 2015). La identificación de potenciales dianas terapéuticas cuya inhibición pudiera afectar a la totalidad de la masa tumoral sin resultar tóxica para los tejidos normales sería la estrategia clínica ideal. Esta búsqueda, por razones obvias, resulta extremadamente complicada en pacientes humanos con tumores avanzados, la situación que frecuentemente se encuentra al momento del diagnostico.
Como aproximación experimental a este problema e hipótesis de partida especulamos con la posibilidad de que el estudio de los estadios más tempranos del proceso tumoral pudiera identificar nuevos mediadores del oncogén K-RAS en adenocarcinoma de pulmón. Estos factores, al ser requeridos desde las etapas iniciales del tumor podrían resultar igualmente esenciales en una mayoría de las células tumorales más avanzadas –independientemente de las alteraciones acumuladas durante etapas posteriores– pero su identificación en este estadio sería dificultada precisamente por su elevada heterogeneidad.
Para evaluar experimentalmente esta novedosa aproximación utilizamos inicialmente un modelo de ratón modificado genéticamente desarrollado en nuestro laboratorio que recapitula fielmente el desarrollo e histopatología del adenocarcinoma de pulmón humano (Guerra et al, 2003). Este modelo es portador en el locus endógeno de una mutación oncogénica K-RasG12V, activable de forma controlada en un número limitado de células pulmonares adultas. Este alelo porta una segunda modificación en forma de un marcador de color co-expresado con el oncogén. Esta característica resultó esencial para el abordaje experimental al permitir identificar a las células positivas para K-RasG12V en una etapa tan temprana en que las células apenas han sufrido variaciones histológicas que las diferencien del tejido normal circundante (Figura 1). Una vez identificadas, estas pequeñas hiperplasias fueron aisladas mediante microdisección por láser. Como control se aislaron mediante el mismo procedimiento regiones adyacentes de tejido alveolar normal. El análisis de su perfil transcripcional reveló la primera sorpresa de este proyecto. Mientras que un 50% de las hiperplasias analizadas mostraron un perfil transcripcional similar al tejido normal, un segundo grupo presentó una alta homología con adenocarcinoma humano avanzado (Sweet-Cordero et al, 2005). Estos resultados demuestran que la agresividad tumoral en adenocacinoma de pulmón se establece en etapas extremadamente tempranas, y, por tanto, no es meramente el resultado de una malignización paulatina a lo largo del tiempo. Entender cuales son los mecanismos moleculares determinantes de la agresividad tumoral en un estadio tan precoz de la enfermedad va a ser una tarea tan fascinante como ilustrativa.
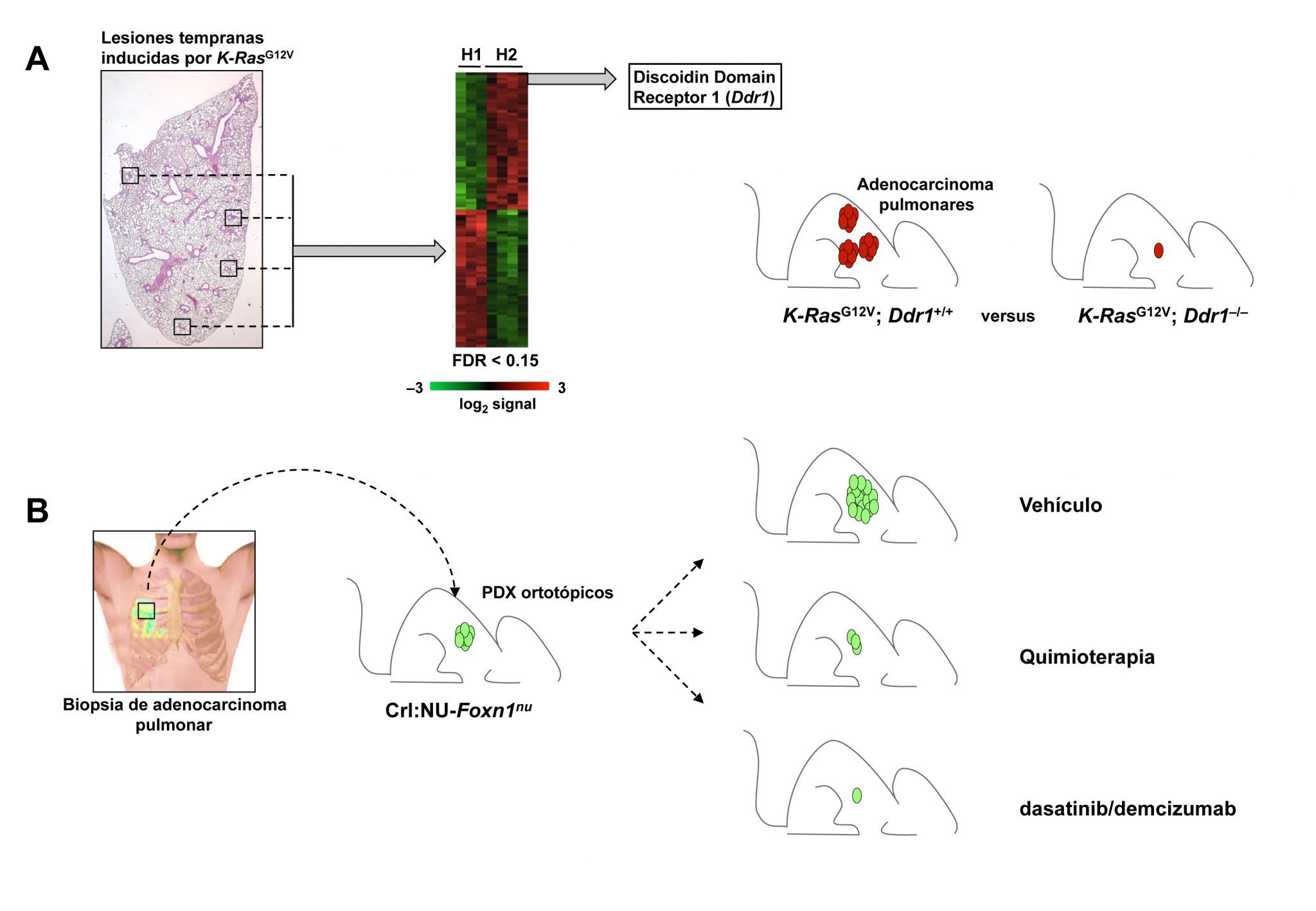
A. Lesiones tempranas de pulmón inducidas por K-RasG12V (≤ 500 células) se microdisectaron y se analizaron mediante tecnología Affimetrix. El transcriptoma de los tumores se agrupó en dos perfiles distintos, uno de los cuales resultó altamente homólogo al obtenido de células alveolares de pulmón normal (H1) y el otro a adenocarcinomas de pulmón agresivos tanto murinos como humanos (H2). El gen con una mejor puntuación en el perfil H2 es Discoidin Domain Receptor 1 (Ddr1). Ratones con genotipo K-RasG12V; Ddr1-/- mostraron supervivencia prolongada y reducción en la carga tumoral en comparación con el grupo control K-RasG12V; Ddr1+/+. B. Las biopsias de pacientes portadores de adenocarcinomas de pulmón con mutaciones en K-RAS y p53 fueron implantados en forma ortotópica en ratones inmunosuprimidos Crl:NU-Foxn1nu y sometidos a tratamientos con vehículo, quimioterapia o dasatinib/demcizumab.
Dado que el objetivo de este proyecto se basaba en la identificación de nuevas dianas terapéuticas centramos nuestro análisis en el perfil transcripcional agresivo. El candidato con una mejor puntuación resultó ser Ddr1 (Discoidin Domain Receptor 1), un receptor de membrana con actividad tirosina quinasa cuya sobre-expresión se había asociado con mal pronóstico en adenocarcinoma de pulmón humano. Su inhibición genética (utilizando animales deficientes para esta quinasa) y farmacológica (mediante el empleo de un inhibidor específico recientemente sintetizado) redujo considerablemente la progresión de los tumores inducidos por K-RasG12V, pero no así en un modelo de mayor agresividad (K-RasG12V; p53–/–) obtenido mediante la eliminación adicional del supresor tumoral p53 (alteración presente en el 50% de adenocarcinomas humanos). Previamente había sido descrito que en líneas de cáncer de mama Ddr1 activa la ruta de señalización Notch como un mecanismo de supervivencia tumoral. Adicionalmente, Notch se había identificado recientemente como una ruta esencial para la progresión del adenocarcinoma de pulmón (Maraver et al, 2012). En consecuencia, planteamos la combinación de inhibidores Ddr1/Notch como una estrategia para incrementar la eficacia de los tratamientos individuales y, efectivamente, su uso conjunto mejoró sustancialmente la respuesta terapéutica induciendo una disminución sustancial del crecimiento de tumores agresivos K-RasG12V; p53–/–. La eficacia terapéutica fue, cuando menos, comparable a la obtenida mediante quimioterapia aunque mucho mejor tolerada.
Como paso final para la validación de la terapia combinada Ddr1/Notch decidimos testar su eficacia en muestras de origen humano. Un estudio retrospectivo de muestras histológicas de adenocarcinoma de pulmón portador de mutaciones en K-RAS confirmó que un alto porcentaje de estos tumores efectivamente presentaban altos niveles de Ddr1 y elevada actividad de la ruta Notch –evaluada por la presencia de Hes1, un conocido efector de esta vía–. Este hecho sugería que, al igual que el modelo animal, serían tumores sensibles a la terapia combinada. Así, en colaboración con el laboratorio de Alberto Villanueva (ICO, Barcelona) se utilizaron biopsias tumorales de tres pacientes de adenocarcinoma de pulmón con mutaciones oncogénicas en K-RAS. Estas biopsias se implantaron en el pulmón de ratones inmunosuprimidos como una mejora de la técnica conocida como PDX (del inglés Patient Derived Xenograft). La implantación en el tejido de origen –a diferencia del subcutáneo realizado habitualmente– mantiene características del microambiente muy importantes para el desarrollo tumoral recapitulando de la forma más precisa posible la enfermedad humana y por tanto mejorando la fiabilidad de la respuesta terapéutica. Finalmente, y con objeto de facilitar una posible implementación clínica del tratamiento combinado se utilizaron inhibidores ya autorizados para uso clínico (dasatinib) o en fase final de aprobación (demcizumab) por la agencia FDA americana. Dasatinib, sintetizado originalmente como inhibidor de la tirosina quinasa Bcr-Abl y aprobado como terapia para leucemias CML y ALL, es también un potente inhibidor de Ddr1. Demcizumab es un anticuerpo monoclonal contra DLL4, uno de los ligandos de la familia de receptores Notch y actualmente en ensayos clínicos tempranos (Fase 1a) en pacientes con adenocarcinoma de pulmón. Ambos fármacos fueron combinados para el tratamiento de los ratones implantados con PDX utilizando las dosis terapéuticas equivalentes a las empleadas en pacientes humanos. El grupo de animales tratados con combinación dasatinib/demcizumab tuvo una respuesta terapéutica –evaluada mediante criterios estrictamente clínicos– significativamente mayor que aquellos tratados con quimioterapia convencional. El tratamiento combinado resultó en la inducción de necrosis y reducción de la masa tumoral. Asimismo resultó en una disminución sustancial y prolongada de la señal de PET (Tomografía por emisión de Positrones), una medida clínica de la actividad metabólica y agresividad del tumor. Por último, se observó un aumento significativo de la supervivencia de los animales incluso tras la discontinuación del tratamiento farmacológico. A nivel molecular, los tumores sometidos al tratamiento combinado mostraron una inhibición de distintas vías implicadas en la proliferación y supervivencia tumoral como p-Erk, p-Akt, p-p38, Bcl-2 y Bcl-xL. Este resultado es consecuencia de un claro efecto aditivo de ambos inhibidores mediante un mecanismo molecular todavía por dilucidar. No podemos descartar que el efecto antitumoral sea parcialmente mediado por la inhibición de procesos o compartimentos adicionales a las propias células tumorales. En este sentido se ha descrito que la inhibición de Notch tiene un efecto antiangiogénico y, efectivamente, observamos una drástica reducción de la neovascularización de la masa tumoral que podría cooperar en la inducción de necrosis causada por la terapia combinada.
En resumen, nuestros resultados demuestran que el estudio de los mecanismos moleculares involucrados en la iniciación del adenocarcinoma de pulmón identifica potenciales dianas con eficacia terapéutica en tumores avanzados superior a los tratamientos convencionales.
Artículo original:
Ambrogio C et al. Combined inhibition of DDR1 and Notch signaling is a therapeutic strategy for KRAS-driven lung adenocarcinoma. Nat Med. 2016 Feb 8. doi: http://dx.doi.org/10.1038/nm.4041
Referencias
Guerra C et al. Tumor induction by an endogenous K-ras oncogene is highly dependent on cellular context. Cancer Cell. 2003 4:111-20.
Maraver A et al. Therapeutic effect of γ-secretase inhibition in KrasG12V-driven non-small cell lung carcinoma by derepression of DUSP1 and inhibition of ERK. Cancer Cell. 2012 22:222-34.
McGranahan N & Swanton, C. Biological and therapeutic impact of intratumor heterogeneity in cancer evolution. Cancer Cell. 2015 27: 15-26.
Sweet-Cordero A et al. An oncogenic KRAS2 expression signature identified by cross-species gene-expression analysis. Nat Genet. 2005 37:48-55.

