Lluís Espinosa y Carlota Colomer
Instituto Hospital del Mar de Investigaciones Médicas (IMIM), Parque de Investigación Biomédica de Barcelona, 08003 Barcelona
El cáncer de colon y recto (CCR) es actualmente la segunda causa de mortalidad por cáncer en los países occidentales. Además, este tipo de cáncer es el segundo y el tercero más frecuente en mujeres y hombres, respectivamente, a nivel mundial.
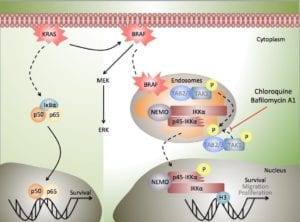
A nivel molecular, aproximadamente un 40% de los tumores en estadios avanzados tiene mutaciones genéticas en el oncogén KRAS, lo que ha convertido a dicha proteína en la principal diana terapéutica para el desarrollo de nuevas estrategias antitumorales. La proteína KRAS es el mediador principal de las señales activadoras del receptor del factor de crecimiento epitelial (EGFR) y ejerce muchas de sus funciones, tanto en células normales como tumorales, a través de la activación de las quinasas de la familia RAF, las cuales y de forma secuencial activarán a las quinasas MEK y ERK. No es por lo tanto sorprendente que la proteína BRAF se encuentre también mutada en un gran número de tumores, incluyendo un 15% de todos los tumores de colon y recto, y un porcentaje mucho mayor de los melanomas malignos. Tanto las mutaciones en KRAS, como las más recientemente descubiertas mutaciones en BRAF, se asocian en general a un peor pronóstico de la enfermedad, ya que, mientras por un lado favorecen la proliferación y la supervivencia de las células tumorales, por el otro impiden el uso de inhibidores del EGFR, que suelen incluirse en los protocolos habituales para el tratamiento de tumores avanzados metastásicos. Debido a la alta toxicidad de los inhibidores de KRAS, muchos de los esfuerzos encaminados al tratamiento del CCR con mutaciones en KRAS y BRAF se han centrado en el desarrollo de inhibidores de la actividad quinasa de BRAF o MEK, los cuales han demostrado una gran efectividad al incrementar la supervivencia de los pacientes. No obstante, en muchos de los casos el uso de estos inhibidores se ha visto limitado por la aparición de resistencias, lo cual nos lleva nuevamente a la necesidad de identificar nuevas dianas terapéuticas en la vía de señalización de EGFR-KRAS-BRAF que permitan mejorar las expectativas de los pacientes, tanto en monoterapias, como en combinación con los distintos fármacos actualmente en uso y/o desarrollo.
Recientemente nuestro grupo de investigación ha demostrado que en las células de CCR existe una forma truncada de la proteína quinasa IKKa, a la que hemos denominado p45-IKKa, que favorece la supervivencia celular y es esencial para el desarrollo de los tumores en modelos de ratón. Además, hemos comprobado que BRAF induce la activación de p45-IKKa a través de una vía no-convencional asociada a los endosomas. Lo que es aún mas relevante desde un punto de vista clínico, nuestros resultados indican que los inhibidores de la actividad endosomal (como la cloroquina que se usa actualmente para la prevención y el tratamiento de la malaria, o la bafilomicina A1, un agente antibacteriano, antifúngico e inmunosupresor) impiden la activación de p45-IKKa en las células de cáncer de colon, inhibiendo así el crecimiento tumoral tanto in vivo como in vitro. Además, en un modelo de xenotransplante ortotópico en ratones immunosuprimidos, el tratamiento con cloroquina o bafilomicina A1 potencia el efecto de la quimioterapia convencional, no sólo reduciendo significativamente el tamaño tumoral, sino también impidiendo su capacidad metastásica.
Nuestra propuesta es que la inhibición de la acidificación endosomal, ya sea mediante la utilización de los fármacos actualmente disponibles o mediante nuevas moléculas más selectivas sobre las que ya estamos actualmente investigando, podría proporcionar una nueva e inesperada propuesta para tratar pacientes con tumores dependientes de la actividad KRAS/BRAF. En la misma dirección, la detección p45-IKKa activada en el tejido tumoral podría considerarse como una primera herramienta con valor pronóstico para determinar aquellos pacientes candidatos a beneficiarse de las nuevas terapias basadas en la inhibición de la actividad endosomal.
Referencias:
Margalef P, et al. A truncated form of IKKα is responsible for specific nuclear IKK activity in colorectal cancer. Cell Rep. 2012 Oct 25;2(4):840-54. doi: 10.1016/j.celrep.2012.08.028.
Margalef P, et al. BRAF-induced tumorigenesis is IKKa-dependent but NF-kB–independent. Sci. Signal. 2015 April 21. Vol. 8, 373ra38.