Marianela Candolfi1, Neha Kamran2,3, Pero R Lowenstein2,3, Maria G Castro2,3.
1 Instituto de Investigaciones Biomédicas (INBIOMED, UBA-CONICET). Facultad de Medicina, Universidad de Buenos Aires, Argentina.
2 Department of Neurosurgery, The University of Michigan School of Medicine, MSRB II, RM 4570C, 1150 West Medical Center Drive, Ann Arbor, MI 48109-5689, USA
3 Department of Cell and Developmental Biology, The University of Michigan School of Medicine, MSRB II, RM 4570C, 1150 West Medical Center Drive, Ann Arbor, MI 48109-5689, USA
[tabby title=»Español»]
El glioblastoma multiforme (GBM) es el tumor cerebral primario más agresivo y frecuente. El carácter altamente invasivo de estos tumores hace que la resección quirúrgica completa sea virtualmente imposible. Esto, sumado a la resistencia de las células de glioma a las terapias convencionales, y al carácter inmunosupresor del micro-entorno del tumor, hace que el tumor recurra y sea letal en la mayoría de los pacientes. Por estas razones, es necesario el desarrollo de estrategias que detecten y erradiquen las células tumorales que invaden el cerebro, sin afectar el tejido no neoplásico que las rodea. Las estrategias inmunoterapéuticas contra el cáncer de cerebro tienen como objetivo la activación específica de células T antitumorales que eliminen las células tumorales residuales presente en el parénquima cerebral tras el tratamiento tradicional, reduciendo así la probabilidad de recurrencias.
Con el objetivo de inducir inmunidad antitumoral en pacientes con GBM, desarrollamos una estrategia de terapia génica que consiste en dos vectores adenovirales (Ads) no replicativos: (i) Ad.TK codifica para la enzima citotóxica condicional, e.g., timidina quinasa, derivada del virus Herpes Simplex 1 (HSV-TK), que, en presencia del pro-fármaco ganciclovir lleva a la apoptosis de células en proliferación. Las células del glioma apoptóticas liberan antígenos tumorales y moléculas proinflamatorias intracelulares, por ej. HMGB1 (Candolfi, 2014 ; Curtin, 2009; Candolfi, 2009); (ii) Ad.Flt3L codifica para la citoquina Flt3L, que induce la expansión y reclutamiento de células dendríticas en el microambiente tumoral (Curtin, 2009; Candolfi 2012), las cuales captan antígenos tumorales, los transportan a los ganglios linfáticos y activan la expansión clonal de linfocitos citotóxicos y de memoria. En estudios preclínicos, este tratamiento induce inmunidad antitumoral adaptativa y regresión de tumores intracraneales en múltiples modelos animales de GBM, promoviendo la supervivencia a largo plazo y la memoria inmunitaria (Candolfi, 2014 ; Curtin, 2009; Ghulam Muhammad, 2009). Esta estrategia está siendo evaluada en un ensayo clínico de fase I en pacientes con GBM, (en la Universidad de Michigan, Departamento de Neurocirugía) que reciben inyecciones de los vectores en la cavidad tumoral tras la resección quirúrgica del tumor (https://clinicaltrials.gov: NCT01811992).

Si bien existe evidencia de inmunidad antitumoral en pacientes con GBM que reciben inmunoterapia, como por ejemplo vacunas antitumorales, en general esta respuesta es insuficiente para lograr un beneficio clínico significativo. Esto parece deberse a los múltiples mecanismos inmunosupresores que desarrollan el GBM: (i) la expresión de citoquinas inmunosupresoras como TGF-β, VEGF, IL-10 y PGE2; (ii) la presencia de checkpoints inmunológicos, receptores inhibidores de linfocitos T CTLA-4 y PD-1 y sus ligandos (PD-L1), (iii) el reclutamiento de células inmunosupresoras hacia el microambiente tumoral, como las células supresoras de origen mieloide (MDSCs), los linfocitos T reguladores (Tregs) y los macrófagos asociados a tumor (TAMs).
Las MDSCs están implicadas en la escasa respuesta inmunitaria al GBM (Raychaudhuri, 2011; Fujita, 2011). Las MDSCs son una población de células inmunes con actividades inmunosupresoras que juegan un papel importante en la inhibición de la inmunidad antitumoral en varios modelos de cáncer en roedores y también en los cánceres humanos. Estas células inmunosupresoras también han sido descriptas en GBMs humanos (Rodrigues, 2010). Las MDSCs son una población heterogénea de células compuesta por células progenitoras mieloides y células mieloides inmaduras (IMCs). En condiciones normales, las IMCs generadas en la médula ósea (MO) se diferencian en macrófagos, células dendríticas (CDs) o granulocitos maduros. La diferenciación de IMCs en células mieloides maduras parece ser obstaculizada por factores producidos por el tumor, dando como resultado la acumulación de MDSCs, que carecen de los marcadores de superficie normalmente expresados por monocitos, macrófagos o CDs. En ratones, las MDSCs se caracterizan por co-expresar los antígenos de diferenciación del linaje de las células mieloides, Gr1 y CD11b.
Varios grupos, incluyendo el nuestro, han demostrado que la expansión de MDSCs puede ser desencadenada por factores endógenos derivados de tumor, los cuales pueden estimular la mielopoyesis e inhibir la diferenciación a células mieloides maduras. Las MDSCs inhiben la expansión y función de los linfocitos T citotóxicos a través de múltiples mecanismos, que incluyen la producción de factores inmunosupresores como la arginasa y la sintasa de óxido nítrico inducible (iNOS), especies reactivas del nitrógeno y del oxígeno y la producción de IL-10 y expresión de ligandos de “chekpoints” inmunológicos como PD-L1 y CD80.
Con el objeto de mejorar la inmunidad antitumoral inducida por la inmunoterapia, en nuestro reciente artículo publicado en Molecular Therapy evaluamos si el bloqueo de la acumulación de MDSCs en el microambiente tumoral podría mejorar la respuesta a la terapia con Ad.TK y Ad.Flt3L en modelos murinos de GBM. En este trabajo observamos que las MDSCs intratumorales pueden constituir hasta el 80% de los infiltrados inmunes del GBM. El reclutamiento de MDSCs parece depender del perfil genético del tumor ya que los porcentajes de infiltración de MDSCs varían significativamente entre los distintos tumores experimentales. De hecho, ha sido reportado previamente que el ratio de MDSCs vs linfocitos T CD8+ es mayor cuando los tumores experimentales carecen de p53.
Nuestro estudio indica que las MDSCs que infiltran los tumores expresan las moléculas tolerogénicas IL4Ralfa, arginasa, iNOS, PD-L1 y CD80 y son potentes inhibidores de la activación de los linfocitos T. Con el objeto de potenciar la respuesta antitumoral de linfocitos T inducida por el tratamiento con Ad.TK+Ad-Flt3L administramos anticuerpos bloqueantes de Gr-1. Los anticuerpos anti-Gr-1 redujeron el contenido de MDSCs en tumor, bazo y sangre y aumentaron significativamente la respuesta de linfocitos T citotóxicos, anti-tumoralesy la sobrevida de los animales tratados con Ad.TK+Ad.Flt3L. La combinación de la inmunoterapia génica con la administración sistémica de anticuerpos que bloquean la activación de los checkpoints inmunológicos, como anti-CTLA4 y anti-PD-L1, también resultó en un incremento de la supervivencia a largo plazo de los ratones portadores de GBM. Nuestros resultados indican que las MDSCs constituyen un blanco terapéutico critico en el tratamiento del GBM. La depleción de las MDSCs, así como de la neutralización de checkpoints inmunológicos podría mejorar la eficacia de las estrategias inmunoterapéuticas diseñadas para tratar el GBM, como la inmunoterapia génica con Ad.TK+Ad-Flt3L o las vacunas antitumorales de péptidos o de CDs. Dado que la combinación de estrategias que estimulan al sistema inmune con la neutralización de mecanismos inmunosupresores mejora la respuesta antitumoral y que la administración de los anticuerpos bloqueantes de CTLA-4, PD-1 y PD-L1, así como la inmunoterapia con Ad.TK+Ad-Flt3L, se encuentran en evaluación clínica en pacientes con GBM, la combinación de estas estrategias podría ser evaluada en pacientes con GBM para optimizar las respuestas antitumorales.
[tabby title=»English»]
Myeloid suppressor cells as therapeutic targets to boost antitumor immunity against glioblastoma
Glioblastoma multiforme (GBM) is the most aggressive and frequent primary malignant brain tumor. Since GBM is highly invasive, complete surgical resection is virtually impossible. In addition, the intrinsic resistance of GBM cells to conventional therapies and the immunosuppressive tumor microenvironment favor tumor recurrence, which ultimately kills the patient. Thus, novel therapies that detect and specifically eradicate GBM cells spread throughout the brain parenchyma are urgently needed. The aim of immunotherapeutic strategies against brain cancer is to specifically activate antitumor T lymphocytes that kill the GBM cells that remain after traditional therapy, reducing the risk of recurrences.
In order to induce antitumor immunity in GBM patients, we developed a gene therapy strategy that consists of two non-replicative adenoviral vectors (Ads): (i) Ad.TK encodes for the conditionally cytotoxic enzyme thymidine kinase, derived from the Herpes Simplex Virus (HSV-TK), which in the presence of the prodrug ganciclovir leads to apoptosis of proliferating cells. Apoptotic GBM cells release tumor antigens and intracellular proinflammatory molecules, such as HMGB1 (Candolfi, 2014 ; Curtin, 2009; Candolfi, 2009); (ii) Ad.Flt3L encodes for the cytokine Flt3L that induces the expansion and recruitment of dendritic cells (DCs) into the tumor microenvironment (Curtin, 2009; Candolfi 2012), which in turn uptake tumor antigen, transport them to the draining lymph nodes and activate the clonal expansion of cytotoxic and memory T cells. Our preclinical studies indicate that this treatment induces antitumor adaptive immunity and intracranial tumor regression in multiple GBM animal models, leading to long term survival and immunological memory (Candolfi, 2014 ; Curtin, 2009; Ghulam Muhammad, 2009). This therapeutic strategy is currently being evaluated in a Phase I clinical trial in GBM patients that are injected with the Ads into the tumor bed after surgical resection (https://clinicaltrials.gov: NCT01811992, Department of Neurosurgery, University of Michigan).
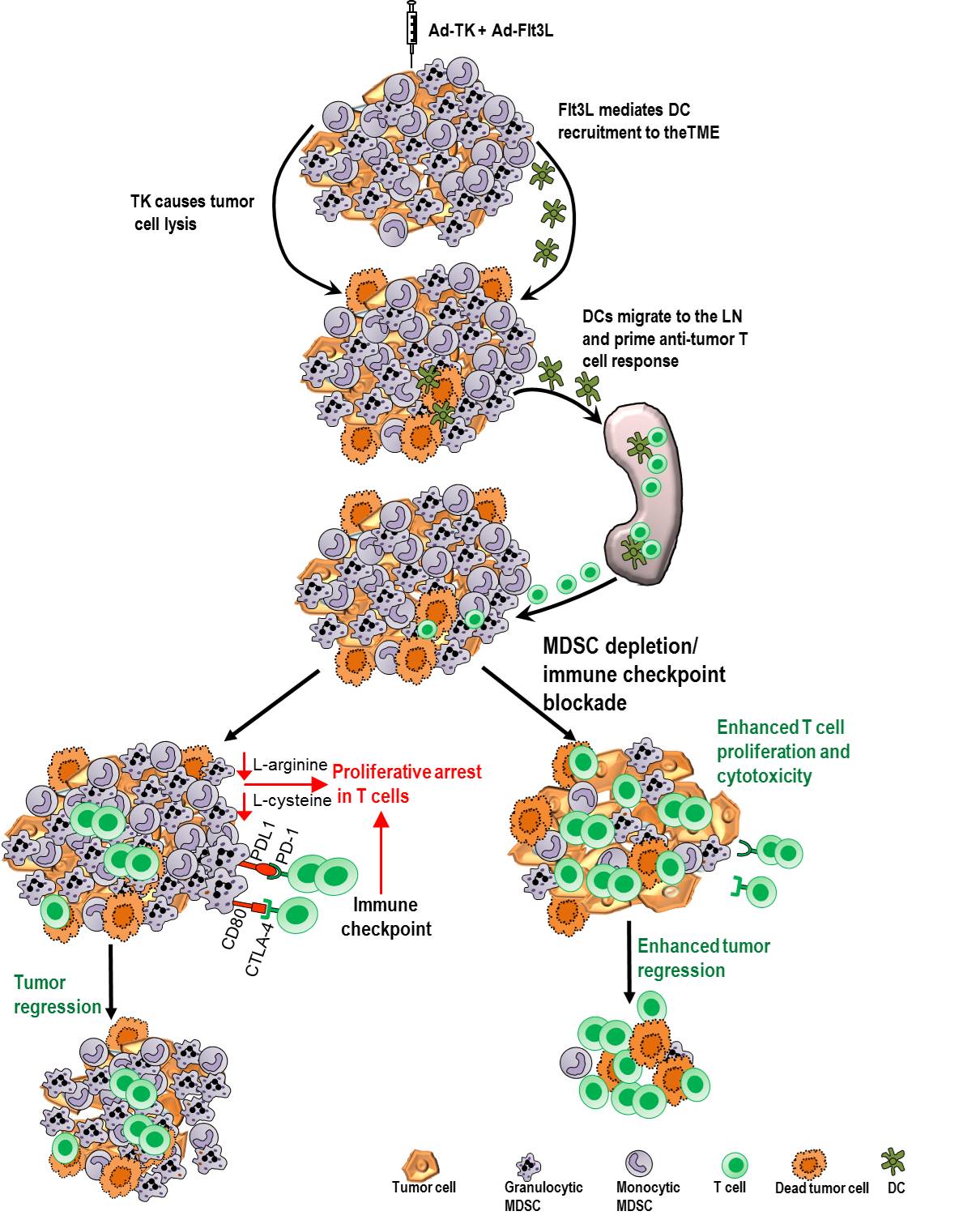
Although there is evidence of antitumor immunity in GBM patients that receive immunotherapy, such as antitumor vaccines, this response is not adequate to provide a significant therapeutic benefit. This seems to be related to multiple immunosuppressive mechanisms developed by GBM: (i) expression of immunosuppressive cytokines, such as TGF-β, VEGF, IL-10 y PGE2; (ii) the presence of immunological checkpoints, inhibitory T cell receptors CTLA-4, PD-1 and its ligand PD-L1, (iii) recruitment of immunosuppressive cells into the tumor microenvironment, such as myeloid-derived suppressor cells (MDSCs), regulatory T cells (Tregs) and tumor-associated macrophages (TAMs).
MDSCs have been involved in the poor antitumor immunity in GBM (Raychaudhuri, 2011; Fujita, 2011). MDSCs are immune cells with immunosuppressive functions that play an important role in the inhibition of antitumor immunity in multiple animal tumor models, as well as in cancer patients. These immunosuppressive cells have been encountered in human GBM (Rodrigues, 2010). MDSCs constitute a heterogeneous cell population of myeloid progenitor cells and immature myeloid cells (IMCs). Under normal conditions, IMCs are generated in the bone marrow and differentiate to macrophages, DCs or mature granulocytes. IMC differentiation into mature myeloid cells seems to be impaired by tumor-derived factors, resulting in accumulation of MDSCs that lack surface markers expressed by monocytes, macrophages or DCs. In mice, MDSCs are characterized by co-expression of myeloid cell differentiation markers Gr1 and CD11b.
We and others have demonstrated that MDSC expansion can be triggered by endogenous tumor-derived factors, which stimulate myelopoiesis, but inhibit differentiation to mature myeloid cells. MDSCs inhibit the expansion and function of T lymphocytes through multiple immunosuppressive mechanisms such as the expression of Arginase I, inducible Nitric Oxyde Synthase (iNOS), Nitrogen and Oxygen Reactive Species, IL-10 and ligands of immunological checkpoints PD-L1 and CD80.
In order to boost immunotherapy-induced antitumor immunity, in our article recently published in Molecular Therapy we evaluated whether blockade of MDSC accumulation in the tumor microenvironment could improve the response to Ad.TK+Ad.Flt3L treatment in murine models of GBM. We found that tumor infiltrating MDSCs could account for up to 80% of tumor infiltrating immune cells. MDSC recruitment seems to depend on the tumor genetic makeup, as the percentage of MDSC infiltration significantly differs between the experimental tumor type. In fact, it has been previously reported that the ratio between MDSCs and CD8 T cells is higher when experimental tumors lack p53.
Our study shows that GBM-infiltrating MDSCs express tolerogenic molecules IL4Ralpha, Arginase I, iNOS, PD-L1 and CD80 and are potent inhibitors of T lymphocyte activation. In order to boost antitumor T cell responses induced by the treatment with Ad.TK+Ad.Flt3L we administered Gr1 blocking antibodies. Anti-Gr1 treatment reduced the content of MDSCs in the tumor, spleen and blood, and significantly improved the antitumor cytotoxic T cell response and the survival of Ad.TK+Ad.Flt3L-treated animals. Combination of immuno-gene therapy and systemic administration of antibodies that block immunological checkpoints, such as anti-CTLA-4 and anti-PD-L1, also resulted in increased long-term survival of tumor-bearing mice. Our results indicate that MDSCs constitute a key therapeutic target in the treatment of GBM. MDSC depletion, as well as neutralization of immunological checkpoints could improve the efficacy of immunotherapeutic strategies designed to treat GBM, such as immuno-gene therapy or antitumor peptide or DC vaccines. Since combination of therapeutic strategies that stimulate the immune system and the neutralization of immunosuppressive mechanisms improves antitumor responses and considering that CTLA-4, PD-1 y PD-L1 blocking antibodies and Ad.TK+Ad-Flt3L immunotherapy are currently being evaluated in GBM patients, the combination of these therapeutic strategies could be evaluated in GBM patients in order to boost antitumor immunity.
[tabbyending]
Referencia:
Kamran N, et al. Immunosuppressive Myeloid Cells’ Blockade in the Glioma Microenvironment Enhances the Efficacy of Immune-Stimulatory Gene Therapy. Mol Therapy. 2017. Doi: http://dx.doi.org/10.1016/j.ymthe.2016.10.003
Bibliografía:
Candolfi M, et al. Release of HMGB1 in response to proapoptotic glioma killing strategies: efficacy and neurotoxicity. Clin Cancer Res. 2009 Jul 1;15(13):4401-14. doi: 10.1158/1078-0432.CCR-09-0155.
Candolfi M, et al. Plasmacytoid dendritic cells in the tumor microenvironment: immune targets for glioma therapeutics. Neoplasia. 2012 Aug;14(8):757-70.
Candolfi M, et al. Temozolomide does not impair gene therapy-mediated antitumor immunity in syngeneic brain tumor models. Clin Cancer Res. 2014 Mar 15;20(6):1555-65. doi: 10.1158/1078-0432.CCR-13-2140.
Curtin JF, et al. HMGB1 mediates endogenous TLR2 activation and brain tumor regression. PLoS Med. 2009 Jan 13;6(1):e10. doi:10.1371/journal.pmed.1000010.
Fujita M, et al. COX-2 blockade suppresses gliomagenesis by inhibiting myeloid-derived suppressor cells. Cancer Res. 2011 Apr 1;71(7):2664-74. doi:10.1158/0008-5472.CAN-10-3055.
Ghulam Muhammad AK, et al. Antiglioma immunological memory in response to conditional cytotoxic/immune-stimulatory gene therapy: humoral and cellular immunity lead to tumor regression. Clin Cancer Res. 2009 Oct 1;15(19):6113-27. doi: 10.1158/1078-0432.CCR-09-1087.
Raychaudhuri B, et al. Myeloid-derived suppressor cell accumulation and function in patients with newly diagnosed glioblastoma. Neuro Oncol. 2011 Jun;13(6):591-9. doi: 10.1093/neuonc/nor042.
Rodrigues JC, et al. Normal human monocytes exposed to glioma cells acquire myeloid-derived suppressor cell-like properties. Neuro Oncol. 2010 Apr;12(4):351-65. doi: 10.1093/neuonc/nop023.
