Alvaro Eguileor Giné
El sistema CRIPSR/Cas9 es una herramienta de edición genética que permite cortar el DNA en una localización específica. Fue descubierto en las bacterias como un sistema para protegerse de la infección por virus. El complejo CRIPSR/Cas9 esta formado por una enzima nucleasa Cas9 que realiza cortes de la doble cadena del ADN. Además, este sistema consta de unos pequeños ARNs, denominados ARNs guía, que son complementarios, y por lo tanto se unen, a la secuencia del ADN que se quiere cortar. Durante los últimos años los investigadores que han estudiado este sistema se han dado cuenta de que podría ser empleado, no solo para cortar ADN vírico, sino cualquier secuencia de ADN en la localización de elección, cambiando el ARN guía por uno complementario a nuestra diana de interés. Hoy en día esta herramienta ha revolucionado la edición génica y su potencial permite aumentar la habilidad natural de los linfocitos T humanos para luchar contra el cáncer.
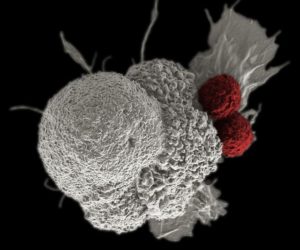
Investigadores de la escuela de medicina Perelman en la Universidad de Pensilvania y del Abramson Cancer Center han publicado recientemente el primer ensayo clínico en fase 1 en humanos en el que evalúan la seguridad y viabilidad de la edición múltiple mediante CRISPR/Cas9 en tres pacientes con cáncer refractario. El equipo demuestra como células inmunes obtenidas del paciente, editadas genéticamente en el laboratorio y posteriormente incorporadas de nuevo al paciente pueden atacar al cáncer incluso meses después de que el paciente las reciba. Los resultados han sido publicados en la revista Science. Este estudio es la continuación de un trabajo previo en el que los investigadores emplearon la tecnología CRIPSR/Cas9 para editar correctamente las células inmunes de tres pacientes de cáncer.
La metodología empleada en este estudio es muy similar a la terapia celular CART, en la que las células inmunes del paciente son modificadas para luchar contra el cáncer, pero presenta algunas diferencias. Al igual que en la terapia CART, los investigadores en este estudio comienzan recogiendo linfocitos T de la sangre del paciente. Sin embargo, en vez de incluir en estas células un receptor contra una proteína como CD19, emplearon la técnica CRISPR/Cas9 para eliminar tres genes del genoma de estas células. Los dos primeros genes eliminados fueron TCRa (TRAC) y TCRb (TRBC) que codifican las cadenas del receptor endógeno de linfocitos T (TCR), de tal manera que las células puedan ser reprogramadas para expresar un receptor de linfocito T sintético, lo que permite a las células buscar y destruir el tumor. El tercer gen eliminado corresponde a PD-1 un “checkpoint” natural que en ocasiones impide a los linfocitos T realizar sus funciones, mejorando así la inmunidad anti-tumoral. Tras conseguir eliminar estos tres genes, se consiguió una cuarta modificación empleando un lentivirus para incorporar el receptor de linfocito T sintético, que dirige a los linfocitos T a reconocer el antígeno NY-ESO-1. A diferencia de los linfocitos T empleados en la terapia CART, las editadas mediante CRISPR en este estudio no son activas por ellas mismas. Requieren de una molécula denominada HLA-A*02:01, que se expresa únicamente en un subgrupo de pacientes. Esto implica que los pacientes tuvieron que ser previamente cribados en base a esta molécula, para confirmar que eran aptos para el estudio.
Unos meses después de la administración de las células, los investigadores extrajeron sangre y aislaron las células editadas mediante CRISPR, demostrando que las células seguían siendo capaces de matar el tumor. Carl June, autor del trabajo menciona: “Los datos obtenidos de los tres primeros pacientes que fueron incorporados en el ensayo clínico demuestran dos aspectos que hasta el momento nadie ha mostrado previamente. En primer lugar, que se pueden llevar a cabo múltiples ediciones del genoma con precisión durante la manufacturación de las células y las células resultantes sobreviven más en el organismo que en estudios publicados anteriormente. En segundo lugar, las células han mostrado una habilidad sostenida para atacar y eliminar el tumor”. El hecho de que estas células editadas mantuvieran la capacidad anti-tumoral durante un periodo significativamente más largo tras una única infusión es muy alentador.
Se trata de la primera confirmación de la habilidad de la técnica CRISPR/Cas9 para editar múltiples genes en humanos. En estudios previamente publicados este tipo de células sobrevive menos de una semana. Sin embargo, en este estudio han demostrado que estas células editadas pueden sobrevivir hasta nueve meses. Aunque la terapia no funcionó en ninguno de los pacientes, no hubo efectos adversos relacionados con la terapia en ninguno de ellos, demostrando la viabilidad de la edición genética mediante CRISPR en la inmunoterapia aplicada al cáncer. Algunas razones para explicar la falta de eficacia de la terapia incluyen el bajo número de pacientes tratados, posibles limitaciones de NY-ESO-1 como diana, y la incapacidad de eliminar los tres genes en muchas de las células. Los investigadores afirman que estos nuevos datos van a permitir que se continúe investigando y muestran el potencial de esta tecnología para tratar muchas enfermedades que anteriormente no podían ser tratadas o curadas.
Referencia: Stadtmauer E, et al. CRISPR-engineered T cells in patients with refractory cancer. Science. 2020. Doi: 10.1126/science.aba7365.
Fuente: CRISPR-Edited Immune Cells Can Survive and Thrive After Infusion into Cancer Patients.
https://www.pennmedicine.org/news/news-releases/2020/february/crispr-edited-immune-cells-can-survive-and-thrive-after-infusion-into-cancer-patients
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos. Tienes más información aquí.