Amparo Tolosa, Genotipia
Investigadores de la Universidad de California San Francisco han dado un paso de gran relevancia para el estudio de las enfermedades neurológicas al adaptar el sistema CRISPR para modificar la actividad génica en neuronas derivadas de células madre.
Disponer de un modelo de estudio adecuado es un punto crítico para mejorar el conocimiento de los mecanismos biológicos que intervienen en una enfermedad y poder diseñar aproximaciones terapéuticas adecuadas. En muchos casos, los modelos animales reproducen gran parte de los rasgos de las enfermedades y son herramientas apropiadas para investigar sus causas o evaluar posibles tratamientos. En paralelo, los modelos celulares permiten estudiar procesos específicos antes de evaluarse en otros organismos o en los propios enfermos. Sin embargo, no siempre es así.
Investigar las enfermedades neurológicas humanas siempre ha sido un reto para la comunidad científica. Las células afectadas por estas enfermedades son de difícil acceso, por lo que evaluar qué cambios se producen en su interior en relación a la patología no es sencillo. Por esta razón, a menudo se sabe qué mutaciones o genes están implicados en una enfermedad neurológica pero se desconocen los detalles de cómo causan exactamente la patología.
“Uno de los grandes retos del campo es que para la mayoría de estos trastornos, las rutas moleculares precisas a las que deberíamos dirigirnos en el desarrollo de fármacos permanecen sin clarificar”, señala Michael Ward, investigador del Instituto Nacional de Salud y uno de los directores del trabajo.
El desarrollo de las células madre pluripotentes inducidas, también conocidas como iPSC parecía haber resuelto el problema de la disponibilidad de células nerviosas en las que estudiar una enfermedad. Las células iPSC son células madre derivadas de células adultas que pueden dirigirse a diferentes identidades celulares. Así, es posible obtener células de un paciente, reprogramarlas en células madre y posteriormente diferenciarlas en el tipo celular de estudio de interés, como por ejemplo, en células nerviosas.
La aproximación diseñada por los investigadores de la Universidad de California San Francisco permite modificar de forma efectiva la actividad génica de los genes en las células iPSC para ver el efecto que tienen estos cambios de expresión en la función de las neuronas obtenidas a partir de ellas.
Lo que ocurre en el interior de una célula está definido en gran medida por cómo, cuándo, y qué tanto se expresan sus genes. Cambios de expresión de un único gen pueden tener grandes consecuencias para la célula y disponer de herramientas capaces de analizar qué ocurre cuando se modifica de forma específica la expresión de los genes es un paso importante en el estudio de las enfermedades. De este modo, una vez solucionada la limitación de la disponibilidad de células de estudio, el siguiente paso de interés es desarrollar métodos analíticos que permitan modificar y evaluar la actividad de los genes.
La tecnología CRISPR de edición del genoma es una herramienta versátil que se ha utilizado con éxito para generar animales modelo e introducir diferentes modificaciones moleculares en modelos celulares. Idealmente, la combinación de las células iPSC con la tecnología CRISPR de edición del genoma podría hacer posible que los investigadores pudieran introducir cambios específicos en las células reprogramadas antes de diferenciarlas en las células de estudio. No obstante, CRISPR no actúa de forma óptima en las células iPSC.
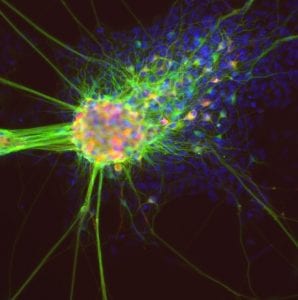
Para entender por qué CRISPR no es eficiente en las células iPSC es necesario comprender su mecanismo de acción. El sistema CRISPR habitual consta de una enzima nucleasa que corta la doble cadena de ADN en la posición que le indica un ARN guía. Posteriormente, CRISPR depende de las herramientas de reparación del ADN para reparar el ADN y se aprovecha de sus errores para general el cambio en la posición exacta.
El problema de utilizar CRISPR en células iPSC es que estas células tienen una respuesta al daño muy activa y la acción de la nucleasa puede llegar a resultar tóxica. Para evitar este problema, los investigadores adaptaron CRISPR como una plataforma de interferencia con la que rastrear el efecto de la inactivación de genes sin introducir cortes en el ADN e inducir toxicidad a las células iPCS. Mediante esta aproximación, los investigadores podrían analizar de forma sistemática, cómo afecta la expresión de un número elevado de genes a la función de las células.
En un primer experimento, el equipo identificó qué genes son necesarios para las células nerviosas y qué genes favorecen la supervivencia cuando su expresión es reducida. A continuación, los investigadores interfirieron la expresión de cada uno de estos genes y secuenciaron el transcriptoma de las células nerviosas derivadas de iPCS para evaluar los efectos derivados de esta interferencia.
El equipo encontró que, sorprendentemente, algunos genes “housekeeping” necesarios para el mantenimiento de las células, actúan de forma diferente en células madre y neuronas diferenciadas. Este resultado plantea que este tipo de genes, esenciales para la supervivencia de la célula, puede funcionar de forma distinta según el tipo celular. Por último, los investigadores analizaron las consecuencias de la interferencia génica a lo largo del tiempo en la morfología de las neuronas.
El estudio, publicado en Neuron, describe una herramienta de análisis con gran potencial para el estudio de las enfermedades neurológicas. Además, los resultados proporcionan nueva información detallada de cuáles son los efectos de múltiples genes en las células nerviosas y revelan cómo los genes de supervivencia pueden funcionar de forma diferente según el tipo celular. Los investigadores utilizarán esta estrategia para estudiar cómo funcionan los genes en las diferentes clases de neuronas y como las mutaciones relacionadas con enfermedades pueden influir en conjuntos concretos de células nerviosas.
En última instancia, el conocimiento obtenido servirá, confían los investigadores, para desarrollar terapias dirigidas a las enfermedades neurológicas. “Con esta tecnología podemos tomar células de la piel o de la sangre de un paciente con una enfermedad degenerativa como el Alzhéimer y convertirlas en neuronas u otras células cerebrales y descubrir qué genes controlan los defectos celulares asociados con la enfermedad”, destaca Martin Kampmann, investigador en el Instituto de Enfermedades Neurodegenerativas de la Universidad de California San Francisco y uno de los directores del trabajo. “La información podría ayudarnos a identificar dianas terapéuticas efectivas”.
Referencia: Tian R, et al. CRISPR Interference-Based Platform for Multimodal Genetic Screens in Human iPSC-Derived Neurons. Neuron. 2019. Doi: https://doi.org/10.1016/j.neuron.2019.07.014
Fuente: Tweaked CRISPR in Neurons Gives Scientists New Power to Probe Brain Diseases. https://www.ucsf.edu/news/2019/08/415166/tweaked-crispr-neurons-gives-scientists-new-power-probe-brain-diseases
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos. Tienes más información aquí.


