Agnès Figueras 1,2 y Francesc Viñals 1,2,3
1 Programa Contra la Resistencia Terapéutica del Cáncer (ProCURE), Instituto Catalán de Oncología, Hospital Duran i Reynals, L’Hospitalet de Llobregat (Barcelona); 2 Instituto de Investigación Biomédica de Bellvitge (IDIBELL), L’Hospitalet de Llobregat (Barcelona); 3 Departamento de Ciencias Fisiológicas, Universitat de Barcelona, Barcelona.
El término cáncer de ovario se utiliza para definir todas aquellas neoplasias malignas que crecen en el ovario. Debido a esta definición meramente por su localización, este tipo de cáncer engloba a diferentes tipos de tumores, con características fisiopatológicas y moleculares muy dispares. El 90% de los tumores de ovario tienen un origen epitelial (EOC) y se clasifican siguiendo criterios histológicos y genéticos en cinco grandes grupos: serosos de alto grado (80% de los diagnósticos y de características más agresivas, responsables del 80% de las muertes debidas al cáncer de ovario), serosos de bajo grado (<5%), endometroides (15%), mucinosos (<5%) y tumores de célula clara (<5%)(Bast, 2009; Bowtell 2010). Aun siendo sólo el quinto tumor por número de casos en las mujeres (1 de cada 3.000 en España), sólo 2 de cada 5 pacientes sobrevive pasados los cinco años desde su diagnóstico. Además, a diferencia de otros tumores como los de mama o colon, en el caso del cáncer de ovario la supervivencia no ha mejorado en los últimos 40 años. ¿A qué se debe?
En primer lugar al diagnóstico tardío debido a que sus síntomas clínicos son compartidos con otras afecciones de menor importancia. Así, un 80% de los casos se diagnostican cuando la enfermedad ya ha diseminado a órganos pélvicos (lo que se denomina estadio FIGO II), al abdomen (FIGO III) o fuera de la cavidad peritoneal (FIGO IV) y sólo el 20% presentan el tumor todavía confinado en el ovario (FIGO I). Dicha diseminación y metástasis harán la cirugía mucho más complicada y su curación mucho más difícil. Y en segundo lugar, la baja supervivencia se debe a la baja respuesta de las células tumorales a los tratamientos con terapias habituales (quimioterapia y/o radioterapia), lo que denominamos resistencia de novo o refractariedad al tratamiento. Además, tumores que sí responden inicialmente al tratamiento con quimioterapia, evolucionan rápidamente en el paciente y adquieren lo que llamamos resistencia adquirida, volviendo a progresar y acabando por diseminar y metastatizar (Vaughan 2011).
Frente a estas expectativas tan negativas en el cáncer de ovario, en otros tipos de tumores, como el de mama, se ha producido un claro aumento de la supervivencia en los últimos años. Ello ha sido posible gracias a un mejor diagnóstico y clasificación molecular, lo que ha permitido obtener tratamientos más específicos para cada subtipo de tumor. Para conseguir nuevos tratamientos más específicos y eficientes en cáncer de ovario es necesario identificar nuevos métodos para un diagnóstico más precoz de la enfermedad y llegar a conocer los mecanismos implicados tanto en la resistencia de novo como en la adquirida, así como aquellos implicados en la capacidad diseminativa y metastásica. Nuestro estudio sobre el papel de CXCR4 en la metástasis en cáncer de ovario incide en este último punto (Figueras 2018).
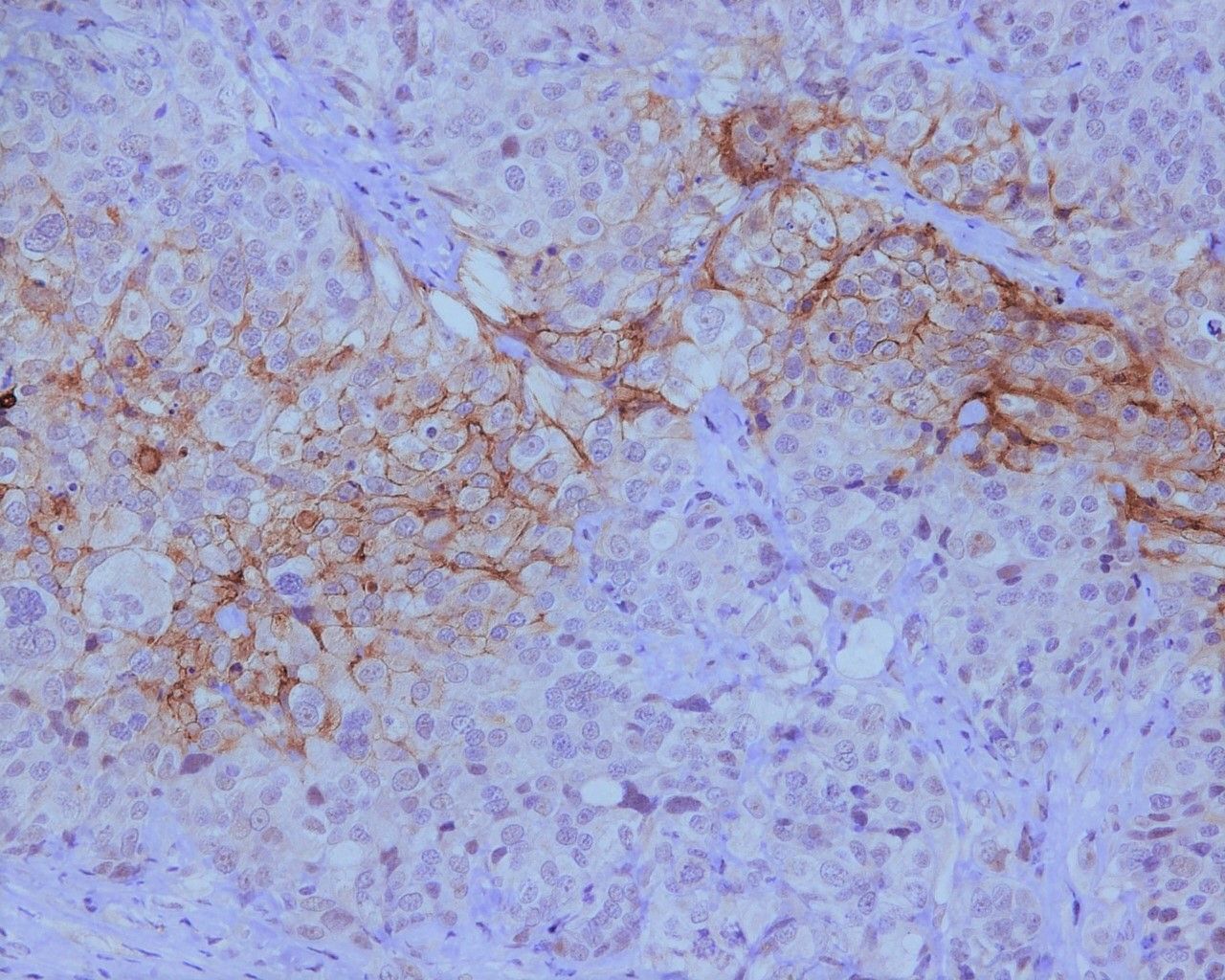
CXCR4 es un receptor de membrana de la familia de los receptores “serpentin” (con 7 dominios proteicos que atraviesan la membrana plasmática). Sus funciones son quimiotácticas: las células que lo expresan serán atraídas hacia zonas del organismo que expresen su molécula ligando, en este caso CXCL12 (también conocido como SDF1). Se han descrito altos niveles de expresión de CXCR4 y un papel importante del receptor en el movimiento de células hematopoyéticas, endoteliales y también en diversos tipos tumorales (Domanska 2013). Se conocía desde hace ya unos años su papel en la metástasis en diferentes tipos de cáncer, como el de mama, próstata y también en el de ovario.
Nuestros resultados han permitido descubrir que aquellos tipos de cáncer de ovario más agresivos y diseminativos son los que expresan niveles más altos de CXCR4. En ellos CXCR4 activa señales de supervivencia y proliferación, lo que favorece que estas células tumorales sean capaces de sobrevivir tanto en la cavidad peritoneal como en su viaje a través de los vasos sanguíneos (diseminación hematógena). Estas células viajeras por la sangre son las que conocemos como células tumorales circulantes o CTCs, responsables en gran medida de la aparición de metástasis.
Expresar CXCR4 confiere así una ventaja clara a la células tumorales para poder dar lugar a CTCs y metástasis. Dicha ventaja a nivel molecular se basa en la inducción del proceso conocido como EMT o transición epitelio mesénquima. Este es un proceso plástico que consiste en hacer cambiar la forma de una célula desde una más romboide, unida a sus vecinas e incapaz de moverse fácilmente (forma epitelial), a una más alargada, independiente y móvil como es la forma de las células mesenquimales (como las células llamadas fibroblastos). Las células que siguen una mayor EMT serán las más móviles y metastáticas.
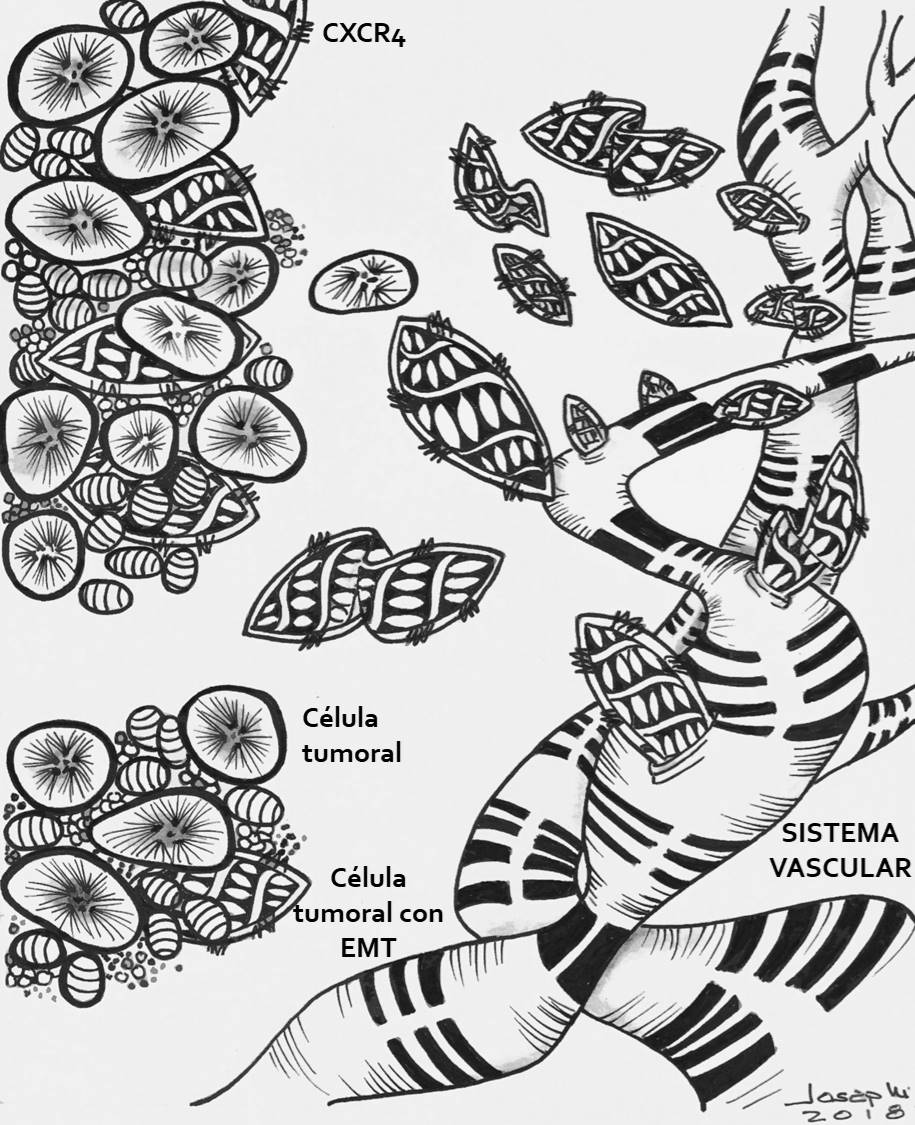
Nuestro estudio también demuestra que para la inducción de EMT por parte de CXCR4 es necesaria la activación de una proteína quinasa intracelular llamada Src. La buena noticia es que existen compuestos que son capaces de bloquear la función de CXCR4 directamente o inhibir a Src en distintas fases de su desarrollo clínico (Chaudary 2017; Ocana 2017). Hemos podido demostrar que estos compuestos inhibidores de CXCR4 son capaces de provocar la muerte de las células tumorales CXCR4 positivas y por tanto, disminuir el tamaño del tumor. Pero además, dicho tratamiento es capaz de disminuir drásticamente la diseminación peritoneal, la aparición de CTCs en sangre y la consecuente aparición de metástasis en estos tumores.
¿Cómo pueden ayudar nuestros resultados a mejorar el tratamiento del cáncer de ovario? En primer lugar, aquellas pacientes con tumores positivos para CXCR4 tendrán más posibilidades de tener metástasis, y por lo tanto, deberán ser seguidas con muchísima más atención si cabe para la detección precoz de nódulos metastáticos. En segundo lugar, un tumor positivo para CXCR4 sabemos que será sensible al tratamiento con inhibidores dirigidos a bloquear la acción de esta molécula e incluso, a fármacos contra la actividad de Src. Estos inhibidores también tendrán un efecto positivo sobre las metástasis y diseminaciones locales. Por tanto, este descubrimiento ofrecerá a las pacientes que presenten un tumor positivo para CXCR4 y hayan progresado a la terapia convencional, la posibilidad de utilizar estos fármacos dirigidos contra CXCR4 o contra Src como nuevas líneas de tratamiento. Estos estudios esperamos que ayudarán a realizar una mejor clasificación de los tumores de ovario, y por tanto, ofrecer mejores tratamientos a las pacientes.
Referencia:
Figueras A, et al. A Role for CXCR4 in Peritoneal and Hematogenous Ovarian Cancer Dissemination. Mol Cancer Ther. 2017 Nov 16. doi: http://dx.doi.org/10.1158/1535-7163.MCT-17-0643
Bibliografía:
Bast RC Jr, Hennessy B, Mills GB. The biology of ovarian cancer: new opportunities for translation. Nat Rev Cancer. 2009 Jun;9(6):415-28. doi: http://dx.doi.org/10.1038/nrc2644
Bowtell DD. The genesis and evolution of high-grade serous ovarian cancer. Nat Rev Cancer. 2010 Nov;10(11):803-8. doi: http://dx.doi.org/10.1038/nrc2946
Chaudary N, et al. Plerixafor Improves Primary Tumor Response and Reduces Metastases in Cervical Cancer Treated with Radio-Chemotherapy. Clin Cancer Res. 2017 Mar 1;23(5):1242-1249. doi: http://dx.doi.org/10.1158/1078-0432.CCR-16-1730
Domanska UM, et al. A review on CXCR4/CXCL12 axis in oncology: no place to hide. Eur J Cancer. 2013 Jan;49(1):219-30. doi: http://dx.doi.org/10.1016/j.ejca.2012.05.005
Ocana A, et al. A phase I study of the SRC kinase inhibitor dasatinib with trastuzumab and paclitaxel as first line therapy for patients with HER2-overexpressing Advanced breast cancer. GEICAM/2010-04 study. Oncotarget. 2017 Apr 14;8(42):73144-73153. doi: http://dx.doi.org/10.18632/oncotarget.17113
Vaughan S, et al. Rethinking ovarian cancer: recommendations for improving outcomes. Nat Rev Cancer. 2011 Sep 23;11(10):719-25. doi: http://dx.doi.org/10.1038/nrc3144