Marcel Ruiz-Mejias1, María Martínez de Lagrán2,3,4, María V Sanchez-Vives1,5, Mara Dierssen2,3,4
1 Neurociencia de Sistemas, Instituto de Investigaciones August Pi i Sunyer (IDIBAPS), Barcelona, España
2 Neurobiología Celular y de Sistemas, Centro de Regulación Genómica (CRG), Instituto de Ciencia y Technología de Barcelona, Barcelona, España
3 Universidad Pompeu Fabra (UPF), Barcelona, España
4 Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) Barcelona, España
5 Institut Català de Recerca i Estudis Avançats (ICREA) 08010 Barcelona, España
El síndrome de Down se caracteriza por la presencia de tres copias del cromosoma 21 o de alguno de sus segmentos. Se ha sugerido que la triplicación de uno o más genes de este cromosoma puede tener una contribución importante en las diferentes características del proceso, incluyendo el fenotipo físico, la propensión a cardiopatías o los déficits cognitivos. Es por este motivo que se han desarrollado diferentes modelos en ratones en los que se estudia el papel de cada gen o región cromosómica implicada en el conjunto de rasgos cognitivos que definen esta patología, con el objetivo de comprender mejor las bases neurobiológicas de la disfunción intelectual.
De entre los modelos que se han usado con este propósito, se ha generado un ratón transgénico que presenta un nivel aumentado de la expresión del gen DYRK1A, un gen del cromosoma 21 humano que codifica una kinasa -una proteína que fosforila otros substratos proteicos- implicada en diferentes procesos sinápticos y de plasticidad estructural, así como en la migración neuronal en los embriones durante el neurodesarrollo (Altafaj y col, 2001). Este gen, que se encuentra en el cromosoma 16 del ratón, ha sido propuesto como un candidato a generar los déficits cognitivos que se encuentran asociados al síndrome de Down. Debido a sus características, este modelo transgénico resulta útil para determinar el papel de este gen en dichos déficits y, aún más importante, cuáles son las alteraciones que provoca en el cerebro que pueden ayudarnos a entender y explicar estos déficits.
Dado que muchos de los déficits cognitivos en el síndrome de Down se encuentran asociados a la corteza prefrontal, nos propusimos estudiar la actividad bioeléctrica rítmica de esta región en los ratones transgénicos DYRK1A. Nuestro objetivo era identificar posibles alteraciones celulares o de red neuronal en el circuito prefrontal que puedan subyacer a las alteraciones cognitivas.
La corteza cerebral genera actividad rítmica oscilatoria que revela la activación sincronizada de neuronas en diferentes frecuencias. Por ejemplo, durante el sueño profundo -y también bajo ciertos regímenes de anestesia- las neuronas oscilan orquestadas en ondas que llamamos lentas, que se caracterizan por alternar periodos de actividad o periodos UP y de silencio o estados DOWN, a una frecuencia alrededor de 1 Hz (Steriade y col, 1993; Ruiz-Mejias y col, 2011). Los periodos de actividad, además, presentan otros tipos de ondas asociadas más rápidas. Algunas de estas ondas rápidas son semejantes a las que se generan en el estado de vigilia durante la actividad cognitiva, llamadas frecuencias gamma, de entre 30 y 90 Hz (Buzsáki, 2012). Estos distintos tipos de actividad se ven reflejados en las señales eléctricas que obtuvimos de la corteza prefrontal de los ratones anestesiados, conocidas como potenciales locales de campo (PLC).
Las señales PLC obtenidas fueron analizadas de dos modos: por un lado, se aplicó un algoritmo matemático para detectar los estados de activación de las ondas lentas, que permitió estudiar la actividad de grupos de neuronas durante esos estados; por otra parte, se obtuvo su espectro de potencias mediante análisis de Fourier, mostrando el contenido de frecuencias de las señales. En ellos se pudo analizar la forma y amplitud de cada banda de frecuencias, como las gamma. En estos experimentos se encontró que tanto la tasa de disparo de las neuronas en los UP states como la potencia en frecuencia gamma (30-90 Hz) estaban disminuidas en los ratones transgénicos de DYRK1A. Estos hallazgos se corroboraron en experimentos con ratones despiertos, donde también se vio que las neuronas disparaban menos y las frecuencias gamma estaban disminuidas.
Las ondas lentas se generan preferencialmente en el área prefrontal, y desde ahí viajan a través de la corteza, en un fenómeno que se conoce con el nombre de propagación. En este estudio se tomaron también medidas de esta propagación de las ondas a través de la corteza de los ratones anestesiados. Vimos que en los ratones transgénicos de DYRK1A las ondas se ralentizaban a medida que se alejaban del área prefrontal de la corteza, hecho que sugería que había alteraciones en el circuito por el que viajan las ondas.
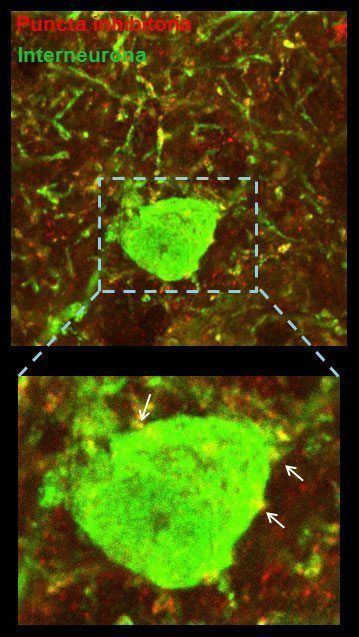
Los resultados de menor tasa de disparo, ondas gamma disminuidas y propagación más lenta nos hicieron pensar que la corteza del ratón transgénico de DYRK1A podía estar sobre-inhibida. Para intentar identificar las bases estructurales de las alteraciones funcionales observadas realizamos una serie de experimentos anatómicos donde se marcaron diferentes poblaciones de neuronas inhibitorias para ver si alguna población específica estaba aumentada, causando de esta manera una mayor inhibición de la corteza. La sorpresa fue que ninguna subclase de neuronas inhibitorias -parvalbúminas, calretininas, somatostatinas- presentó cambios. Se cuantificaron también el número de terminales presinápticos -llamados puncta– excitatorios e inhibitorios de la corteza prefrontal. El resultado reveló que el número total de puncta inhibitorias estaba disminuido en el ratón transgénico mientras que el de puncta excitatorias no mostraba un cambio evidente, es decir parecía haber menor inhibición. Esto era sorprendente: si la hipótesis era que la corteza estaba sobre-inhibida, este resultado lo cuestionaba contundentemente.
Para saber si el número de puncta estaba alterado dependiendo de la población neuronal post-sináptica, se contaron las puncta excitatorias o inhibitorias teniendo en cuenta el tipo neuronal sobre el que hacen contacto. La sorpresa fue que encontramos que los terminales inhibitorios estaban disminuidos cuando contactaban una neurona inhibitoria. Este resultado fue clave, porque mostraba que las neuronas inhibitorias -o interneuronas- estaban menos inhibidas, lo que se conoce como una disminución en la inhibición recurrente. La desinhibición de las neuronas que inhiben (o silencian) a las neuronas excitatorias se puede traducir en una «superinhibición» de las neuronas excitatorias, que representan el 80% de las neuronas corticales. Este hallazgo en la estructura del circuito era compatible con los resultados funcionales observados en el estudio de los ritmos de la corteza prefrontal
Para cuantificar la verosimilitud del hallazgo, empleamos un modelo computacional de la red prefrontal que demuestra como una disminución de la recurrencia inhibitoria es suficiente para explicar la disminución de la actividad gamma y de la tasa de disparo de las neuronas observadas experimentalmente.
La importancia de este trabajo es que por primera vez se asocia un cambio de la actividad emergente de un circuito cerebral a un cambio en su arquitectura en modelos in vivo de síndrome de Down, situando en punto de mira la hipótesis de la recurrencia inhibitoria disminuida, que podría subyacer a los déficits cognitivos observados en las personas con síndrome de Down.
Este ha sido un trabajo colaborativo en el que además de los arriba firmantes han colaborado investigadores del Instituto Superior de Sanidad de Roma, de la Universidad Pompeu Fabra y de la Universidad Pablo de Olavide.
Referencia
Marcel Ruiz-Mejias, Maria Martinez de Lagran, Maurizio Mattia, Patricia Castano-Prat, Lorena Perez-Mendez, Laura Ciria-Suarez, Thomas Gener, Belen Sancristobal, Jordi García-Ojalvo, Agnès Gruart, José M Delgado-García, Maria V Sanchez-Vives, Mara Dierssen (2016). Overexpression of Dyrk1A, a down syndrome candidate, decreases excitability and impairs gamma oscillations in the prefrontal cortex. The Journal of Neuroscience, 36(13), 3648-3659. doi: 10.1523/JNEUROSCI.2517-15.2016.
Bibliografia
Altafaj X et al. Neurodevelopmental delay, motor abnormalities and cognitive deficits in transgenic mice overexpressing Dyrk1A (minibrain), a murine model of Down’s syndrome. Hum Mol Genet. 2001 Sep 1;10(18):1915-23.
Buzsáki G and Wang XJ. Mechanisms of gamma oscillations.Annu Rev Neurosci. 2012;35:203-25. doi: 10.1146/annurev-neuro-062111-150444.
Ruiz-Mejias M et al. (2011). Slow and fast rhythms generated in the cerebral cortex of the anesthetized mouse. Journal of neurophysiology, 106(6), 2910-2921.
Steriade M et al. A novel slow (<1 Hz) oscillation of neocortical neurons in vivo: depolarizing and hyperpolarizing components.J Neurosci. 1993 Aug;13(8):3252-65.

