Autores: Marta Fernández-Nogales, Jorge R. Cabrera, María Santos-Galindo, Jeroen J.M. Hoozemans, Isidro Ferrer, Annemieke J.M. Rozemuller, Félix Hernández, Jesús Avila y José J. Lucas
La Enfermedad de Huntington (EH), es una enfermedad neurodegenerativa hereditaria, caracterizada por trastornos motores como la corea, alteraciones psiquiátricas y pérdida de las funciones cognitivas que progresan hasta la muerte del paciente típicamente entre quince y veinte años después de la aparición de los primeros síntomas. Esta causada por una mutación en el gen IT-15 que codifica para la proteína huntingtina (htt), consistente en una expansión desmesurada de tripletes CAG que codifica un tracto expandido de poliglutamina en la proteína htt.
Las Tauopatías son un grupo de enfermedades neurodegenerativas, en las que se incluyen la enfermedad de Alzheimer y la demencia frontotemporal con parkinsonismo asociada al cromosoma 17 (FTDP-17), caracterizadas por una alteración del metabolismo y la deposición de la proteína asociada a microtúbulos tau. El splicing alternativo del exón 10 del gen MAPT que codifica para la proteína tau, da lugar a isoformas de tau con tres o cuatro repeticiones del dominio de unión a microtúbulos (3R- y 4R-tau). Está descrito que mutaciones intrónicas en familias con FTDP-17 provocan un incremento del ratio 4R/3R y esto, por sí mismo, es suficiente para causar esta enfermedad neurodegenerativa que cursa con cambios de personalidad, demencia y disfunción motora.
En este reciente estudio, nos propusimos comprobar si en la EH se produce un incremento del ratio 4R/3R de las isoformas de tau que explicara en parte la neurodegeneración asociada a la enfermedad.
En primer lugar, observamos que en pacientes de EH se produce un incremento de las isoformas 4R y una disminución de las isoformas 3R tanto a nivel de ARNm como de proteína además de un incremento de tau total en las regiones del cerebro más afectadas por la enfermedad, el estriado y la corteza. Comprobamos que esta alteración correlaciona con el secuestro del factor de splicing SRSF6 en los cuerpos de inclusión característicos de la EH. Este secuestro junto con la probable alteración de su actividad a la vista del incremento de su fosforilación en los cerebros de EH, favorecería la inclusión del exón 10 de tau y, por tanto, un incremento del 4R.
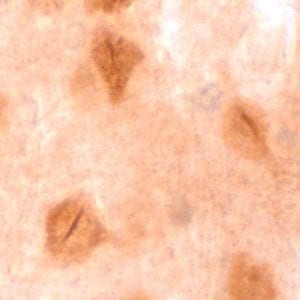
Seguidamente, a nivel histopatológico, observamos la existencia de una nueva marca consistente en unos depósitos de tau con forma de bastón que abarca total o parcialmente los núcleos de determinadas neuronas estriatales y corticales de los pacientes de EH mientras que en controles aparecen de forma esporádica. Por microscopía electrónica pudimos comprobar que los bastones se encuentran rellenando invaginaciones de la envuelta nuclear que cruzan el núcleo parcial o totalmente. Además, esta marca también la hemos podido observar en cerebros de pacientes de Alzheimer, la tauopatía clásica por excelencia. Todos estos resultados fuimos capaces de reproducirlos en ratones transgénicos para la EH.
Finalmente, para explorar si el incremento del ratio 4R/3R y del tau total proporciona una ganancia de función tóxica, decidimos llevar a los ratones transgénicos para la EH, a un fondo heterocigoto y homocigoto knockout de tau. Comprobamos que estos ratones con reducción parcial o total de tau, presentan una mejoría significativa en diferentes test de comportamiento de coordinación motora. Esto indica, por tanto, que tau contribuye de forma significativa al fenotipo motor observado en los ratones transgénicos de EH y que está jugando un papel en la patogénesis de la enfermedad.
Los resultados de este trabajo apuntan que la EH es una tauopatía ya que cursa con un incremento del ratio 4R/3R capaz de provocar neurodegeneración y con la aparición de una nueva marca histopatológica consistente en depósitos de tau en forma de bastones nucleares. Este descubrimiento además de ampliar el campo de conocimiento acerca de lo que ocurre en la EH, abre la posibilidad del uso de todos los conocimientos que se tienen sobre la proteína tau y el uso de herramientas farmacológicas en desarrollo para otras tauopatías debido a que hemos demostrado que la EH está más próxima a la enfermedad de Alzheimer de lo que se pensaba.
Referencia: Fernandez-Nogales, M., et al., Huntington’s disease is a four-repeat tauopathy with tau nuclear rods. Nature medicine, 2014. doi: 10.1038/nm.3617.
Afiliaciones:
Centro de Biología Molecular “Severo Ochoa” (CBMSO) Consejo Superior de Investigaciones Científicas y Universidad Autónoma de Madrid (CSIC/UAM): Marta Fernández-Nogales, Jorge R Cabrera, María Santos-Galindo, Félix Hernández, Jesús Avila y José J Lucas
Centro de Investigación en Red en Enfermedades Neurodegenerativas (CIBERNED), Instituto de Salud Carlos III: Marta Fernández-Nogales, Jorge R Cabrera, María Santos-Galindo, Isidro Ferrer, Félix Hernández, Jesús Avila y José J Lucas
Departamento de Neurociencias, Neuroscience Campus Amsterdam, VU University Medical Center: Jeroen J M Hoozemans y Annemieke J M Rozemuller
Instituto de Investigación Biomédica de Bellvitge (IDIBELL)- Hospital Universitario de Bellvitge, Universidad de Barcelona: Isidro Ferrer