Esteban A. Orellana1,2 y Andrea L. Kasinski1,3
1 Department of Biological Sciences, Purdue University, West Lafayette, IN 47907, USA.
2 PULSe Graduate Program, Purdue University, West Lafayette, IN 47907, USA.
3 Purdue Center for Cancer Research, Purdue University, West Lafayette, IN 47907, USA.
Durante la última década se han identificado microARNs (miARN, pequeños ARNs no codificantes que regulan la expresión génica) con propiedades tumor-supresoras como posibles agentes terapéuticos para tratar el cáncer. Se conoce que cualquier alteración de los niveles de expresión de los miARNs contribuye a un estado cancerígeno y se ha demostrado que la re-expresión ectópica de miARNs, la cual puede haberse perdido en tumores y algunos tejidos, tiene beneficios terapéuticos. Un ejemplo de esto ocurre con el microARN-34a (miR-34a), un gen supresor tumoral que es regulado transcripcionalmente por p53, el cual, al ser reintroducido en células tumorales, provoca la reducción en la proliferación celular en tumores e incrementa la supervivencia en modelos animales de cáncer de pulmón (Kasinski et al. 2012).
Se espera que las terapias de reemplazo de microARNs tengan un efecto importante a nivel clínico. Sin embargo, este tipo de tratamientos todavía están dando sus primeros pasos y hay aspectos críticos que necesitan ser solucionados para su avance terapéutico. Uno de los retos más importantes es el diseño de un método eficiente para la liberación del microARN en los tejidos afectados. Al igual que ocurre con otros pequeños ARNs (e.g. ARN de silenciamiento, oligonucleótidos anti-sentido), el desarrollo de miARNs como terapia se encuentra entorpecido por la falta de un sistema de administración eficiente con baja toxicidad.
En nuestro estudio, publicado recientemente en la revista Science Translational Medicine, se puso a prueba la liberación de un miARN terapéutico y un ARN de silenciamiento conjugados con un ligando cuyo receptor se encuentra sobre-expresado en tejidos tumorales (Orellana et al. 2017). La hipótesis era que al usar un ligando para mediar la entrega del miARN se consiguen dos objetivos: 1) alta especificidad para el tejido blanco y 2) baja toxicidad al evitar el uso de un vehículo (lípido, nanopartícula, etc.). Pusimos a prueba nuestra hipótesis al conjugar un dúplex sintético de miR-34a a un grupo folato (vitamina B9), cuyo receptor se encuentra sobre-expresado en las células cancerígenas, generando así una molécula a la que llamamos FolamiR (Folato-miARN).
Las moléculas de FolamiR fueron analizadas in vitro usando células humanas de cáncer de mama e in vivo en modelos murinos de cáncer de mama y pulmón. Los resultados de estos experimentos proporcionan evidencias de que la entrega de moléculas de FolamiR es altamente específica y limitada a tejidos con sobre-expresión del receptor de folato, además muestran que el miARN sigue siendo funcional y capaz de reducir la velocidad de crecimiento celular y tumoral.
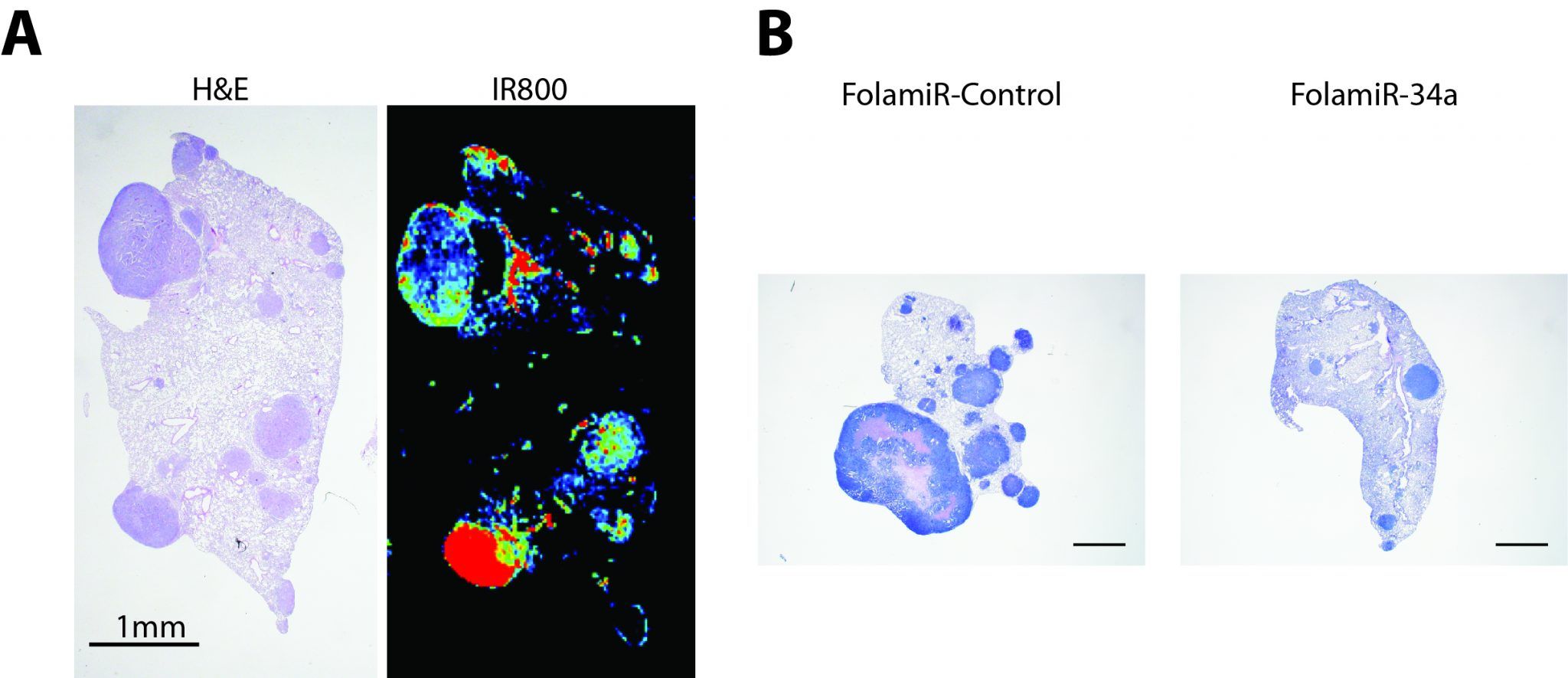
Estos resultados son alentadores debido a que la entrega de miARNs sintéticos no encapsulados de manera sistémica presenta retos como la poca estabilidad de las moléculas de ARN en suero, su rápida excreción del cuerpo o que pueden inducir a la activación del sistema inmune (Whitehead et al. 2009). Es por esto, que diseñamos los dúplex sintéticos de miARNs con mínimas modificaciones químicas (2´ -O- Metil ribonucleótidos) que proveen cierta protección en contra de nucleasas y evitan una posible estimulación al sistema inmune.
No se observaron signos de toxicidad en las dosis usadas en los estudios (dosis máxima: 26.64 mg/kg) lo cual da soporte a la hipótesis de que al eliminar el vehículo se disminuye la toxicidad sin impedir la entrega ni la actividad del miARN.
Una de las limitaciones de este método de liberación es la posibilidad de que el FolamiR quede secuestrado en endosomas, ya que la internalización está mediada por la interacción entre el ligando y el receptor. De ser así, para incrementar el potencial terapéutico de los FolamiRs sería necesario implementar mecanismos de escape de los endosomas. Creemos que el desarrollo e inclusión de dichos mecanismos podría ayudar a conseguir mayor eficacia terapéutica y reducir aún más la toxicidad. El reto es continuar diseñando y probando nuevos ligandos para la liberación de miARNs para lograr que su distribución sea altamente específica, rápida y no toxica.
Referencia: Orellana EA, et al. FolamiRs: Ligand-targeted, vehicle-free delivery of microRNAs for the treatment of cancer. Sci Transl Med. 2017;9(401):1-11. doi:10.1126/scitranslmed.aam9327
Fuente: New cancer therapy eliminates toxic delivery vehicles for microRNA. https://www.purdue.edu/newsroom/releases/2017/Q3/new-cancer-therapy-eliminates-toxic-delivery-vehicles-for-microrna.html
Bibliografía:
Kasinski AL, et al. miRNA-34 prevents cancer initiation and progression in a therapeutically resistant K-ras and p53-induced mouse model of lung adenocarcinoma. Cancer Res. 2012;72(21):5576-5587. doi:10.1158/0008-5472.CAN-12-2001
Whitehead KA, et al. Knocking down barriers: advances in siRNA delivery. Nat Rev Drug Discov. 2009;8(2):129. doi:10.1038/nrd2742
