Marc Carceles-Cordon1, Veronica Rodriguez-Bravo1,2 y Josep Domingo-Domenech1
Departments of Pathology1 and Oncological Sciences2. Icahn School of Medicine at Mount Sinai. New York. NY. USA.
![Adenocarcinoma de próstata. Imagen: By Ming Yin, Rajiv Dhir and Anil V Parwani [CC BY 2.0 (http://creativecommons.org/licenses/by/2.0)].](https://genotipia.com/wp-content/uploads/2017/01/795px-Prostate_histology.jpg)
GATA2 en la historia natural del cáncer de próstata
El crecimiento y extensión arquetípicos del cáncer de próstata se desarrollan a lo largo de diversas etapas, cada una más agresiva y terapéuticamente más compleja que la anterior, y con un manejo y tratamiento específicos. Cuando el tumor primario, recluido en los confines de la próstata, no se doblega frente a las estrategias radioterápicas o quirúrgicas pertinentes, su expansión por el organismo utilizando andrógenos para su proliferación y supervivencia marca el inicio del proceso de diseminación. A nivel molecular, esto lo hace mediante la unión del receptor de andrógenos (AR) y otros co-activadores a las regiones reguladoras de genes como PSA o TMPRSS2, ambos regulados positivamente en las células tumorales. Esta etapa, también llamada andrógeno-dependiente, constituye la primera en la extensión del cáncer de próstata y a nivel terapéutico es manejada a través de la castración quirúrgica o farmacológica.
En el contexto andrógeno-dependiente, GATA2 se constituye como un regulador maestro que facilita la expresión génica mediada por AR, facilitando consecuentemente su función y, por extensión, actuando como engranaje principal de la expansión tumoral. Los estudios de Wu et al. han servido para caracterizar esta función de GATA2 como regulador maestro y describir su actuación conjunta con otro factor de transcripción, FOXA1 (Wu, 2014). Similarmente, otros estudios han demostrado que la acción paralela de estos dos factores de transcripción se apoya mutuamente para acabar regulando positivamente la señalización de AR en su contexto molecular, probando así la importancia de GATA2 en el crecimiento andrógeno-dependiente de las células tumorales (Wang, 2007).
A pesar de los tratamientos actuales, todos los tumores de próstata avanzados evolucionan a un estado resistente a la castración, lo que evidencia un progreso hacia una fase más letal en la que la dependencia a los andrógenos es trascendida por la agresividad del tumor. Hoy en día es sabido que la señalización mediada por AR se mantiene regulada positivamente durante esta fase a través de diversos mecanismos moleculares, entre los cuales se incluyen un incremento en la expresión génica y proteica de GATA2 (Wang, 2009). Aun ignorando los detalles moleculares que subyacen a la misma, es más que probable que la resistencia a la castración ocurra a través de los mismos mecanismos que favorecen el crecimiento andrógeno-dependiente o, dicho de otra forma, a través de la susodicha contribución de FOXA1 y GATA2 para favorecer el programa transcripcional de AR. En este contexto de resistencia a la castración, por tanto, GATA2 mantiene el papel primordial que poseía en las fases de extensión iniciales.
Las terapias actuales contra esta segunda etapa de la enfermedad incluyen quimioterapia (docetaxel y cabazitaxel) e inhibidores de andrógenos de segunda generación (enzalutamida). Pero ni tan siquiera estas herramientas terapéuticas son capaces de frenar, en algunos casos, la implacable evolución de algunas células tumorales hasta un postrero estado de letalidad en que su supervivencia se mantiene por mecanismos independientes a AR. Aunque la información pertinente a esta última forma de extensión es escasa, y la elucidación de su engranaje molecular insuficiente, GATA2 parece ser un nuevo mediador de la agresividad de estas células tumorales que poseen, simultáneamente, resistencia a la castración e independencia a AR. Mediante mecanismos sustancialmente distintos a los descritos anteriormente, GATA2 actúa como regulador de un grupo de genes que incluye a IGF2, entre otros, para sostener la desmesurada agresividad que clínicamente se traduce en la fase terminal de la enfermedad (Vidal, 2015).
Caracterizando GATA2 como una potencial diana terapéutica
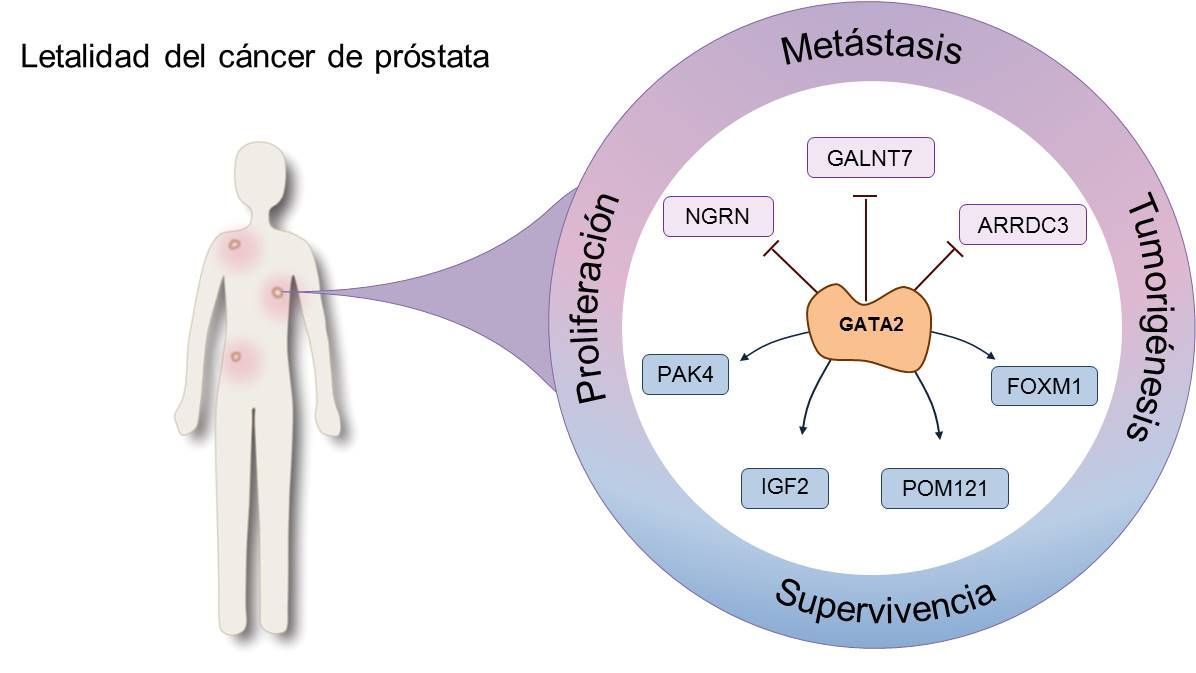
Con lo visto hasta ahora, parece prudente afirmar que GATA2 trasciende la división por etapas del crecimiento tumoral y se mantiene, por uno u otro mecanismo molecular, como articulación fundamental del mismo. Idealmente, esto sitúa a este factor de transcripción en una posición muy favorable para ser una diana terapéutica que pueda frenar la letalidad y progresión del cáncer de próstata en cualquiera que sea el momento del diagnóstico. Con este propósito es imperativo conocer precisamente cuales son estos mecanismos que regulan y son regulados por GATA2, y proponer así estrategias terapéuticas a seguir en el bloqueo de su función.
Describiendo de arriba hacia abajo – es decir, en dirección downstream – la cascada molecular en la que participa GATA2, es natural empezar por aquellas moléculas a través de las cuales GATA2 es regulado. En este contexto, la vía que regula NOTCH mediante su comunicación con PTEN-PI3k-AKT parece ser importante tanto en la regulación de la función hematopoyética de GATA2 como en su papel en la diseminación metastásica de las células tumorales. ETS1, con un papel tumorigénico ya conocido (Adamo, 2016), es capaz de regular directamente la transcripción de GATA2. Y finalmente, la vía de señalización de Hedgehog, crucial también en la patogénesis del cáncer de próstata, controla la expresión de GATA2 (Gonnissen, 2013).
Situados a su mismo nivel, existen también mecanismos epigéneticos y post-transcripcionales que modulan la expresión de GATA2. Por ejemplo, mediante la acetilación de una lisina de la proteína GATA2, p300-CBP modula la transcripción mediada por AR de genes como PSA. Este complejo acetilador puede ser inhibido mediante curcumina y, aunque este bloqueo parece no disminuir la expresión de la proteína AR, sí parece reducir su señalización, lo que resulta en una disminución de la interacción tanto de GATA2 como FOXA1 con sus dianas moleculares en genes como PSA y TMPRSS (Shah, 2012). Siguiendo esta misma línea de investigación, otros estudios clínicos concluyen que la inhibición de esta vía de regulación reduce la concentración en sangre de PSA (Ide, 2010). De todos modos, y aunque semejantes conclusiones alberguen esperanza, aún es necesario asegurar que estos resultados sean fruto de la inhibición de la vía de GATA2 y no de otras concurrentes.
Inversamente, el mismo efecto resultante de inhibir la acetilación de GATA2 podría ser logrado mediante la activación de enzimas deacetilasas como HDAC3 y HDAC5. Así, el derivado de la homopiperazina K-7174 podría truncar la señalización mediada por AR de GATA2 (He, 2014). Otros mecanismos epigéneticos como la fosforilación o la metilación podrían también estar relacionados con la regulación de GATA2, pero es necesaria más evidencia científica al respecto para poder afirmarlo con seguridad.
Finalmente, la inhibición de moléculas situadas downstream de GATA2, como IGF2 o PAK4, podría también facilitar un mecanismo para frenar la extensión y progresión del cáncer de próstata de manera aún incógnita y por descubrir. Respecto la primera, un estudio de Vidal y colaboradores describe IGF2 como potencial ejecutor de la agresividad de GATA2 en las fases terminales de la enfermedad. En este contexto, la inhibición simultánea de IGFR1 y INSR utilizando el inhibidor dual OSI-906 podría ser una herramienta terapéutica de gran utilidad en estas fases letales de la enfermedad en las que las opciones terapéuticas son escasas y altamente inefectivas (Vidal, 2015).
—
A pesar de las estrategias actuales, el cáncer de próstata sigue teniendo el potencial de convertirse en una entidad altamente letal y agresiva contra la cual todo tratamiento acaba siendo fútil. Es indiscutible reafirmar que en el seno de la metamorfosis molecular y funcional que las células tumorales describen a lo largo del proceso natural de la enfermedad hallamos el factor de transcripción GATA2. Tanto mediante mecanismos dependientes de andrógeno y del receptor AR como, eventualmente, a través de procesos independientes de los mismos y que sobrepasan nuestro entendimiento sobre la patología, GATA2 actúa como un motor implacable cuyo propósito es mantener la supervivencia del tumor. Las descripciones moleculares y funcionales que planteamos, respaldadas por el trabajo de numerosos investigadores, plantean la posibilidad de que GATA2 pueda convertirse en una diana terapéutica que nos acerque un poco más a la victoria frente a esta enfermedad.
Referencia
Rodriguez-Bravo, V. et al. The role of GATA2 in lethal prostate cancer aggressiveness. Nat Rev Urol. 2016 Nov 22. doi: 10.1038/nrurol.2016.225.
Bibliografía
Adamo, P. et al. The oncogene ERG: a key factor in prostate cancer. Oncogene. 2016 Jan 28;35(4):403-14. doi: 10.1038/onc.2015.
Gonnissen, A et al. Hedgehog signaling in prostate cancer and its therapeutic implication. Int J Mol Sci. 2013 Jul 4;14(7):13979-4007. doi: 10.3390/ijms140713979.
He, B. et al. GATA2 facilitates steroid receptor coactivator recruitment to the androgen receptor complex. Proc Natl Acad Sci U S A. 2014 Dec 23;111(51):18261-6. doi: 10.1073/pnas.1421415111.
Ide, H. et al. Combined inhibitory effects of soy isoflavones and curcumin on the production of prostate-specific antigen. Prostate. 2010 Jul 1;70(10):1127-33. doi: 10.1002/pros.21147.
Shah, S., et al. Targeting pioneering factor and hormone receptor cooperative pathways to suppress tumor progression. Cancer Res. 2012 Mar 1;72(5):1248-59. doi: 10.1158/0008-5472.CAN-11-0943.
Vidal, S. J. et al. A targetable GATA2–IGF2 axis confers aggressiveness in lethal prostate cancer. Cancer Cell. 2015 Feb 9;27(2):223-39. doi: 10.1016/j.ccell.2014.11.013
Wang, Q. et al. A hierarchical network of transcription factors governs androgen receptor-dependent prostate cancer growth. Mol Cell. 2007 Aug 3;27(3):380-92.
Wang, Q. et al. Androgen receptor regulates a distinct transcription program in androgen-independent prostate cancer. Cell. 2009 Jul 23;138(2):245-56. doi: 10.1016/j.cell.2009.04.056.
Wu, D. et al. Three-tiered role of the pioneer factor GATA2 in promoting androgen-dependent gene expression in prostate cancer. Nucleic Acids Res. 2014 Apr;42(6):3607-22. doi: 10.1093/nar/gkt1382.
