- El trabajo revela que la rotura del ADN en la última fase del ciclo celular, la telofase, hace que se revierta parcialmente la separación de los cromosomas. La segregación de cromosomas en anafase es un fenómeno que hasta ahora se consideraba irreversible.
- La revista Nature Communications acaba de publicar este hallazgo, que firman el estudiante de doctorado de la Universidad de La Laguna Jessel Ayra Plasencia y el Dr. Félix Machín, coordinador del grupo de Inestabilidad Genómica y Cáncer en el Hospital Universitario Nuestra Señora de la Candelaria, en Tenerife.
- Estos hallazgos en levaduras, si se corroboran en el futuro y se extienden a otros tipos celulares (incluyendo células humanas), obligarían a revisar uno de los principios centrales de la Biología Celular.
La rotura de la doble cadena de ADN (abreviado en inglés como DSB) es probablemente el mayor daño genotóxico al que se tienen que enfrentar las células y, paradójicamente, juega un papel esencial tanto en la carcinogénesis como en la terapia antitumoral. Si el DSB ocurre en la fase G1 del ciclo celular, cuando los cromosomas aún no se han replicado, el mecanismo de reparación preferido es la unión de extremos no homólogos (NHEJ en inglés).
En caso de que los cromosomas ya se hayan replicado (fases S, G2 y M del ciclo celular), la recombinación homóloga (HR) con la cromátida hermana es el mecanismo favorecido. La elección entre NHEJ y HR depende en gran medida de la quinasa dependiente de ciclinas (CDK): la baja actividad CDK en G1 favorece la NHEJ, mientras que la alta actividad CDK en el resto del ciclo favorece la HR. Para que la HR tenga éxito resulta además esencial que la cromátida hermana íntegra, que sirve de molde a la cromátida rota, esté próxima físicamente.
Este modelo de control de la reparación de DSBs resulta adecuado para explicar lo que ocurre en G1, S, G2, profase y metafase; sin embargo, la anafase tardía y la telofase resultan escenarios paradójicos a este respecto. Así, las cromátidas hermanas ya no están próximas en estas fases del ciclo, aunque la actividad CDK sigue siendo relativamente alta, lo que favorecería la HR.
En esta reseña comentamos los resultados que hemos obtenido en la levadura Saccharomyces cerevisiae cuando generamos DSBs en telofase con fleomicina, un compuesto radiomimético de la familia de la bleomicina. Esta levadura es ampliamente utilizada como modelo en investigación biomédica básica, pues existe un alto grado de conservación con humanos en los procesos celulares fundamentales, incluyendo la señalización y reparación de los DSBs. Las levaduras presentan además múltiples ventajas experimentales frente a las células humanas en cultivo. Una de ellas, fundamental en este trabajo, es que se pueden sincronizar de forma estable y reversible en telofase, una propiedad que no se puede recrear en otros modelos celulares.
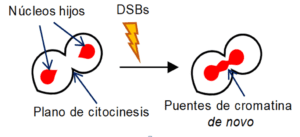
Lo primero que observamos fue que los DSBs en telofase activaban el punto de control del ciclo celular (checkpoint, en inglés) dependiente de daño al ADN. Este checkpoint permitió a las células retrasar varias horas la transición entre la telofase y la siguiente G1, incluyendo la separación física de las células hijas (citocinesis). Sorprendentemente, los núcleos hijos, que estaban perfectamente segregados y dispuestos para albergar la correspondiente dotación cromosómica de las células hijas, comenzaron a acercarse de nuevo. El acercamiento conllevó la formación de nuevos puentes de cromatina y el trasvase de material genético a través del plano de citocinesis. Cuando miramos loci específicos mediante marcaje fluorescente selectivo, observamos eventos de reagrupamiento de loci hermanos, especialmente en telómeros y el ADN ribosomal (nucleolo). Estos reagrupamientos no ocurrieron para los centrómeros. Además, obtuvimos una fuerte evidencia de que el reagrupamiento afecta preferencialmente a loci hermanos donde al menos ha habido un DSB próximo (generando DSBs mediante endonucleasas dependientes de secuencia).
En esta primera parte del trabajo, también pudimos observar una marcada aceleración del movimiento de la cromatina, así como una descondensación local de la misma. Pudimos además demostrar que el reagrupamiento de loci hermanos dependía del checkpoint de daño al ADN, pero no así de la maquinaria de reparación de DSBs por HR (al menos de Rad52, el análogo funcional en levaduras de BRCA2). Sin embargo, la HR sí resultó esencial para sobrevivir a los DSBs en telofase. Esto, junto con el hecho que las tasas de supervivencia en telofase son similares a G2 en células con una HR funcional, nos llevó a concluir que el checkpoint dirige el reagrupamiento de los loci hermanos para que a su vez la HR sea capaz de reparar los DSBs.
En una segunda parte del trabajo, nos preguntamos cómo las células de levadura eran capaces de revertir parcialmente la segregación cromosómica. Para ellos centramos nuestra atención en el huso mitótico. En telofase, el huso está extendido hasta los polos opuestos de lo que van a ser las células hijas, asegurando así la máxima separación entre las cromátidas hermanas. Esto es posible por la acción combinada de las fuerzas ejercidas por los microtúbulos astrales y los interpolares. Los primeros tiran de los centrosomas (en levaduras conocidos como cuerpos polares del huso; SPBs en inglés), mientras que los segundos los empujan en direcciones contrarias. Para la función de los microtúbulos interpolares resulta esencial la acción de la proteína motora quinesina-5 (Cin8, en levaduras).
Lo que observamos, siempre mediante microscopía, fue que los SPBs precedían en su acercamiento a los centrómeros, lo que sugería que estos empujaban a los núcleos hijos a posicionarse más cerca. De hecho, los DSBs dieron lugar a una marcada reorganización del huso mitótico, con un desmantelamiento de los microtúbulos interpolares y un reforzamiento de los astrales. Toda esta reorganización se vio acompañada por una relocalización de Cin8 desde los microtúbulos interpolares a los SPBs. Finalmente pudimos corroborar que la relocalización de Cin8 es debida, al menos parcialmente, a la desfosforilación de residuos claves en su dominio motor, aunque no pudimos identificar la fosfatasa responsable de dichas modificaciones postraduccionales.
En resumen, en este trabajo revelamos por primera vez un escenario donde la segregación de cromosomas puede ser parcialmente revertida antes de concluir la citocinesis. Este escenario se da cuando generamos DSBs en anafase tardía/telofase. La rotura del ADN es un evento genotóxico de gran relevancia durante la carcinogénesis y la terapia antitumoral mediante radioterapia y quimioterapia tradicional. Queda por ver si los resultados obtenidos en levaduras pueden ser extendidos a células humanas, y si en éstas hay una diferencia de respuesta entre sanas y tumorales. En cualquier caso, la reversibilidad de la segregación cromosómica, aunque sea parcial, cuestiona un principio fundamental de la biología celular. Curiosamente, dicha reversibilidad permite responder de forma coherente a la paradoja planteada al inicio: tiene aún sentido promover la HR con la cromátida hermana en las fases finales del ciclo celular.
Esta investigación ha sido financiada por el Ministerio de Ciencia, Innovación y Universidades a través del Programa Estatal de I+D+i, cofinanciado a su vez con Fondos Europeos (proyectos BFU2015-63902-R y BFU2017-83954-R).
Referencia: Ayra-Plasencia J, Machín F. DNA double-strand breaks in telophase lead to coalescence between segregated sister chromatid loci. Nat Commun. 2019. doi: https://doi.org/10.1038/s41467-019-10742-8


