Amparo Tolosa, Genética Médica News
Un análisis genómico acaba de revelar una silenciosa epidemia en los pacientes de fibrosis quística, provocada por una micobacteria resistente a fármacos y adaptada a los humanos.
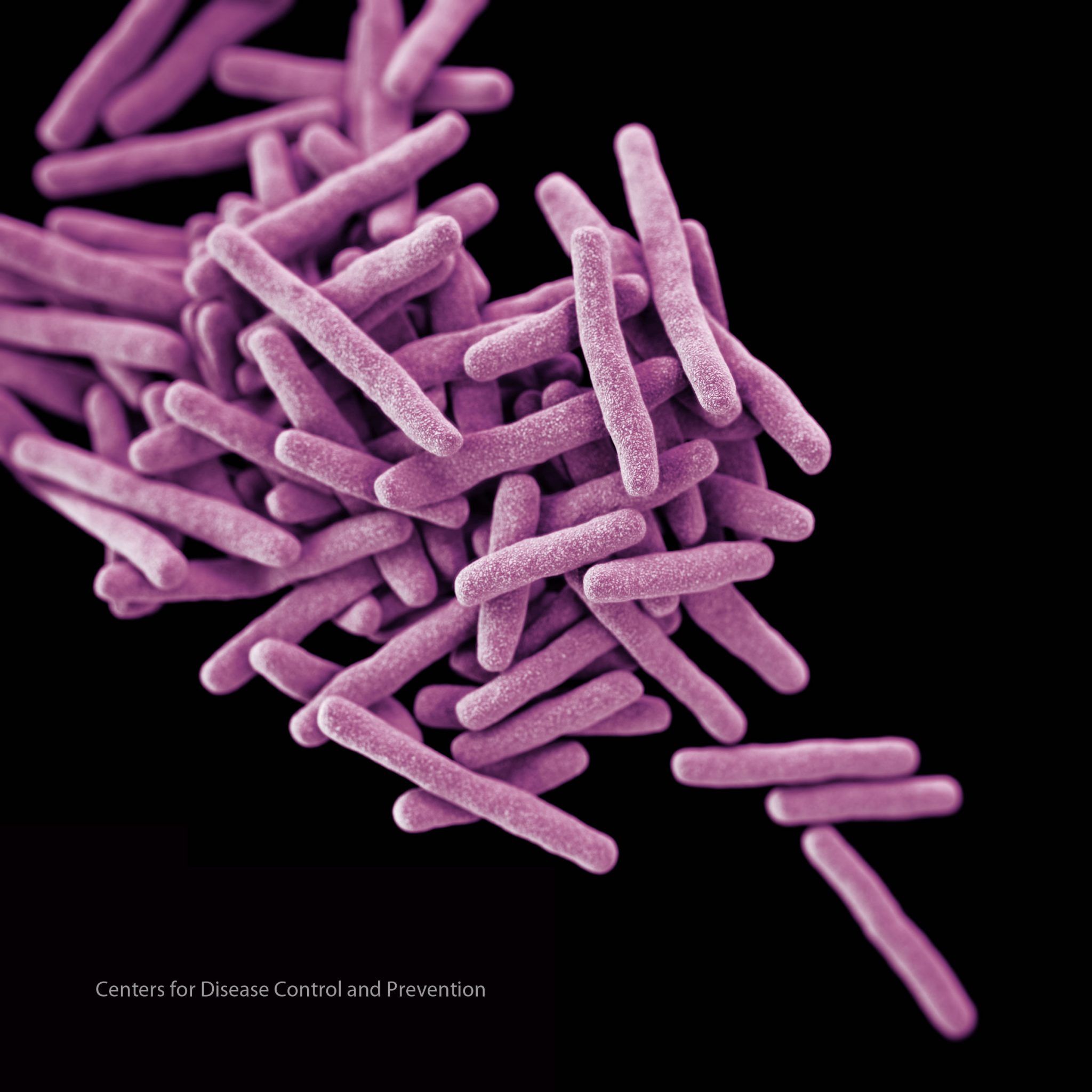
Mycobacterium abscessus es una especie de micobacteria no tuberculosa resistente a fármacos, presente de forma natural en el ambiente. Esta bacteria puede causar infecciones pulmonares en las personas susceptibles, especialmente en aquellas con fibrosis quística, que ya presentan problemas pulmonares causados por la producción excesiva de mucus característica de la enfermedad. En los pacientes con fibrosis quística, la infección con Mycobacterium abscessus es especialmente peligrosa, ya que no puede tratarse, acelera el daño sobre los pulmones, interfiere con el éxito de los trasplantes y puede llegar a causar la muerte.
En los últimos años, la incidencia de infecciones por Mycobacterium abscessus ha aumentado de forma general, tanto en pacientes con fibrosis quística (afectando al 5-10% de los mismos) como en otras personas inmunodeprimidas o susceptibles. Inicialmente, se pensaba que la micobacteria se adquiría de forma totalmente aleatoria a partir del ambiente. Sin embargo, el nuevo trabajo, publicado en Science, sugiere un escenario bien distinto: que la bacteria se ha adaptado a los humanos y que es capaz de transmitirse entre personas por vía aérea a partir de la tos de los pacientes o superficies contaminadas.
Para llegar a estas conclusiones, los investigadores secuenciaron el genoma de 1.000 muestras de la micobacteria obtenidas de aislados de 517 pacientes con fibrosis quística de centros especializados de Europa, Estados Unidos y Australia. Los análisis genómicos revelaron que en muchos casos micobacterias encontradas en pacientes procedentes de diferentes centros, países o incluso continentes, diferían muy poco en su genoma, lo que lleva a considerar que estas infecciones son producidas debido a la transmisión de la bacteria y no a su adquisición del ambiente.

Los investigadores encontraron tres grupos de M.abscessus principales, en base a su similitud genómica. Las bacterias pertenecientes a estos clones tienen una mayor capacidad para sobrevivir en los macrófagos humanos. Además, al considerar la virulencia de las cepas, el equipo encontró que los clones de micobacterias predominantes en los pacientes estaban asociados a una evolución clínica peor en los pacientes y presentan una mayor virulencia en modelos animales. Estos datos sugieren que los tres clones virulentos son fruto de la adaptación genética de la micobacteria que le ha permitido evolucionar desde ser un microorganismo del ambiente a un patógeno del pulmón.
“Esta micobacteria puede causar infecciones muy graves que son extremadamente difíciles de tratar, y requieren el tratamiento combinado con múltiples antibióticos durante 18 meses o más,” señala Andres Floto, profesor de la Universidad de Cambridge y uno de los directores del trabajo. “El microbio parece haber entrado inicialmente en la población desde el ambiente, pero pensamos que ha evolucionado recientemente para ser capaz de saltar de paciente a paciente, haciéndose más virulento en el camino.”
Los investigadores también consideran los mecanismos por los que M. abscessus podía estar transmitiéndose entre individuos y proporcionan evidencias preliminares de que la bacteria se transmite vía superficies u objetos contaminados y también vía aérea a través de la tos de los pacientes.
Respecto a cómo se ha propagado de forma global por el planeta, los mecanismos exactos todavía se desconocen pero los expertos plantean que podrían haber sido las personas sanas las que lo habrían hecho de forma no intencionada.
Los resultados del trabajo, que deberán confirmarse en estudios futuros, sugieren que cepas de M. abscessus más virulentas y adaptadas a humanos se están propagando entre los diferentes centros especializados para pacientes con fibrosis quística, así como entre países y continentes, lo que plantea un importante reto para la práctica clínica en los hospitales. Además, plantean que la limpieza convencional no es suficiente para eliminar la micobacteria, lo que deberá tenerse en cuenta en los protocolos de control de infecciones de los centros clínicos.
“Nuestra investigación proporciona un espacio para la esperanza: ahora que sabemos la extensión del problema y estamos empezando a entender cómo se propaga la enfermedad, podemos empezar a responder,” manifiesta Julian Parkhill, investigador en el Wellcome Trust Sanger y co-director del trabajo. “Nuestro trabajo ya ha ayudado a informar a los responsables de control de infecciones y proporciona los medios para monitorizar su efectividad.”
Referencia: Bryant JM, et al. Emergence and spread of a human-transmissible multidrug-resistant nontuberculous mycobacterium. 2016. Science. Doi: 10.1126/science.aaf8156
Fuente: Multi-drug resistant infection spreading globally among cystic fibrosis patients. http://www.sanger.ac.uk/news/view/multi-drug-resistant-infection-spreading-globally-among-cystic-fibrosis-patients

