Javier Prieto y Josema Torres
Departamento de Biología Celular, Universidad de Valencia
En 2016 se cumplen 10 años desde que Kazutoshi Takahashi y Shinya Yamanaka desarrollaran la técnica de reprogramación celular (Takahashi y Yamanaka, 2006). La reprogramación celular es el proceso por el cual podemos obtener células con pluripotencia inducida o células iPS (del inglés, induced-Pluripotent Stem), a partir de células diferenciadas. El descubrimiento de 2006 fue y sigue siendo, uno de los avances más destacados en el campo de la biología de las últimas décadas.
En el grupo del Dr. Josema Torres de la Unidad de Neurobiología Celular en la Universidad de Valencia, llevamos años estudiando los mecanismos de regulación mitocondrial y metabólica que controlan el proceso de reprogramación celular. Recientemente, hemos publicado un estudio en Nature Communications en el que describimos uno de los mecanismos moleculares que dirigen la reorganización mitocondrial durante la reprogramación celular (Prieto et al. 2016).
Estudios previos habían reflejado diferencias entre la morfología mitocondrial de células iPS y células somáticas. Por un lado, las células somáticas presentan mitocondrias grandes y alargadas, con marcadas y abundantes crestas mitocondriales. Por contra, las células iPS presentan mitocondrias pequeñas e inmaduras, sin crestas (Folmes et al. 2011). Estos datos ponían de manifiesto que durante la reprogramación celular tenía lugar una reorganización de la red mitocondrial de la célula. En este trabajo demostramos que, durante los primeros días de reconversión celular, la fisión mitocondrial juega un papel crucial para que el proceso de reprogramación tenga lugar y describimos además el mecanismo molecular que dirige este proceso.
Tras la transducción de los llamados factores de Yamanaka (Oct4, Sox2, Klf4 y c-Myc), los cuatro factores transcripcionales encargados de inducir la reprogramación, observamos que durante los tres primeros días tiene lugar una profunda reorganización mitocondrial. Así, mientras que las células somáticas presentaban mayoritariamente una morfología mitocondrial tubular, alrededor del 50% de las células contenían las mitocondrias fragmentadas tras la expresión ectópica de los cuatro factores. A los ocho días del proceso de reprogramación aparecen colonias con características epiteliales, los primeros precursores de las células iPS. Observamos que cerca de la totalidad de las células que forman estas colonias poseen también mitocondrias con morfología fragmentada. Mediante el uso del marcador extracelular Thy1 y citometría de flujo, pudimos aislar durante los primeros días del proceso de reprogramación dos poblaciones celulares con marcadas diferencias en la morfología mitocondrial: células Thy1-negativas con mitocondrias fragmentadas y células Thy1-positivas con mitocondrias tubulares.
Cuando utilizamos estas poblaciones celulares en ensayos de reprogramación, observamos que las células Thy1-negativas generaban un mayor número de colonias epiteliales y células iPS que las segundas. Debido a que sólo un pequeño porcentaje de células iniciales (entre el 0,1% y el 5%) consiguen convertirse en células iPS, es muy importante saber que éstas deben de formar parte de la población inicial Thy1-negativa con mitocondrias fragmentadas. Así, la inhibición de la fragmentación mitocondrial durante los primeros días del proceso disminuía marcadamente la eficiencia de reprogramación, poniendo de manifiesto que la fragmentación mitocondrial no sólo tiene lugar durante el proceso sino que es necesaria para la total reconversión celular.
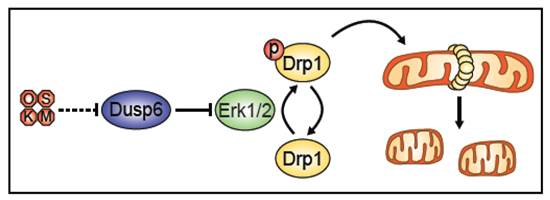
Durante los primeros días de reprogramación, y en paralelo a la fragmentación mitocondrial, tiene lugar la fosforilación de la proteína Drp1. La proteína Drp1 (del inglés, dynamin-related protein 1) es una GTPasa perteneciente a la familia de las dinaminas, y es la responsable en última instancia de la fisión mitocondrial. Sobre la membrana mitocondrial externa existen diversas proteínas de membrana que actúan a modo de receptores de Drp1 atendiendo a su estado de fosforilación. Una vez reclutada sobre la membrana mitocondrial externa, Drp1 comienza a polimerizar formando un anillo contráctil que acaba por fisionar la mitocondria. En nuestro estudio demostramos que, conforme se incrementan los niveles de fosforilación de Drp1, mayor es su reclutamiento a la mitocondria y, en consecuencia, mayor es la fragmentación mitocondrial que tiene lugar.
La activación de Drp1 a través de la MAP quinasa Erk2 había sido descrita recientemente en células humanas transformadas (Kashatus et al. 2015). En nuestro estudio, demostramos que el mecanismo responsable de la inducción de la fragmentación mitocondrial está conformado por el eje Dusp6-Erk1/2-Drp1. Concretamente, la transducción de los cuatro factores de Yamanaka induce un silenciamiento de la expresión del gen Dusp6. La proteína Dusp6 (del inglés, Dual Specificity Phosphatase 6) es una de las fosfatasas citosólicas más importante en el control de Erk1/2. A su vez, Erk1/2 es una de las quinasas centrales en el control de procesos celulares como proliferación, diferenciación y/o supervivencia. El silenciamiento de Dusp6 favorece la activación de Erk1/2, la cual fosforila y activa a Drp1 para orquestar la reorganización de la red mitocondrial.
La contribución de este trabajo en el campo de la reprogramación celular es doble. Por un lado, nuestro trabajo ahonda en el papel de la proteína Erk1/2 en el proceso de reprogramación y pluripotencia. Hasta la fecha, se asumía que la ruta de señalización de Erk1/2 era un ruta pro-diferenciación que, de hecho, era necesario inactivar si se pretendía adquirir un estado basal de pluripotencia (Ying et al. 2008). Sin embargo, nuestro estudio pone de manifiesto que la proteína Erk1/2 puede jugar papeles distintos en diferentes etapas del proceso de reprogramación celular.
Por otro lado, nuestro trabajo remarca la similitud existente entre los procesos de reprogramación y transformación celular. De hecho y de forma similar al trabajo publicado por Kashatus y colaboradores que se ha mencionado anteriormente, en los últimos años han sido numerosos los estudios publicados que relacionan la reprogramación celular con la tumorigénesis. Se han descrito diversos eventos celulares que pueden jugar un papel importante en ambos procesos de conversión celular: transición mesénquima-epitelio (Li et al. 2010; Samavarchi-Tehrani et al. 2010), condiciones de hipoxia (Mathieu et al. 2014), activación del ciclo celular (Li et al. 2009; Marión et al. 2009) y cambios en el metabolismo (Folmes et al. 2011).
En este sentido, el estudio y comprensión del proceso de reprogramación celular no sólo ayudará a manejar una herramienta fundamental en el tratamiento de enfermedades, sino que también podrá esclarecer interrogantes entorno a los pasos iniciales del proceso de transformación celular y, por tanto, de la biología de las células iniciadoras de un proceso canceroso.
Referencia:
Prieto J et al. Early ERK1/2 activation promotes DRP1-dependent mitochondrial fission necessary for cell reprogramming. Nat Commun. 2016 Mar 31;7:11124. doi: 10.1038/ncomms11124.
Bibliografía:
Folmes CD et al. Somatic oxidative bioenergetics transitions into pluripotency-dependent glycolysis to facilitate nuclear reprogramming. Cell Metab. 2011 Aug 3;14(2):264-71. doi: 10.1016/j.cmet.2011.06.011.
Kashatus JA et al. Erk2 phosphorylation of Drp1 promotes mitochondrial fission and MAPK-driven tumor growth. Mol Cell. 2015 Feb 5;57(3):537-51. doi:10.1016/j.molcel.2015.01.002.
Li R et al. A mesenchymal-to-epithelial transition initiates and is required for the nuclear reprogramming of mouse fibroblasts. Cell Stem Cell. 2010 Jul 2;7(1):51-63. doi: 10.1016/j.stem.2010.04.014.
Li H et al. The Ink4/Arf locus is a barrier for iPS cell reprogramming. Nature. 2009 Aug 27;460(7259):1136-9. doi: 10.1038/nature08290.
Mathieu J et al. Hypoxia-inducible factors have distinct and stage-specific roles during reprogramming of human cells to pluripotency. Cell Stem Cell. 2014 May 1;14(5):592-605. doi: 10.1016/j.stem.2014.02.012.
Marión RM et al. A p53-mediated DNA damage response limits reprogramming to ensure iPS cell genomic integrity. Nature. 2009 Aug 27;460(7259):1149-53. doi:10.1038/nature08287.
Samavarchi-Tehrani P et al. Functional genomics reveals a BMP-driven mesenchymal-to-epithelial transition in the initiation of somatic cell reprogramming. Cell Stem Cell. 2010 Jul 2;7(1):64-77. doi:10.1016/j.stem.2010.04.015.
Takahashi K and Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006 Aug 25;126(4):663-76.
Ying QL et al. The ground state of embryonic stem cell self-renewal. Nature. 2008 May 22;453(7194):519-23. doi: 10.1038/nature06968.