William G. Kaelin Jr., Sir Peter J. Ratcliffe y Gregg L. Semenza han sido galardonados con el Premio Nobel de Fisiología y Medicina de 2019 por sus descubrimientos sobre cómo detectan y se adaptan las células a la disponibilidad de oxígeno.

El oxígeno es un elemento necesario para la vida. Es esencial para transformar los nutrientes en energía que pueda ser utilizada por las células. Por lo tanto, las células, tejidos y organismos han desarrollado estrategias para adaptarse a los diferentes niveles de oxígeno. Por ejemplo, existen mecanismos de contingencia en las células para detectar cuándo falta el oxígeno y activar una respuesta destinada a aumentar su disponibilidad. Los trabajos de los tres galardonados han caracterizado el mecanismo por el que muchos tipos celulares de nuestro organismo detectan cambios en la disponibilidad de oxígeno y producen una respuesta génica destinada a adaptarse.
Cómo se adaptan las células a los niveles de oxígeno
Al inicio de los trabajos de William G. Kaelin Jr., Sir Peter J. Ratcliffe y Gregg L. Semenza, se sabía que cuando los niveles de oxígeno disminuyen (lo que se conoce como hipoxia), se produce una respuesta fisiológica para aumentar la producción de eritrocitos de la sangre y aumentar los niveles de oxígeno en sangre. Esta respuesta está mediada por el gen EPO, que codifica para la hormona eritropoyetina. Así, cuando bajan los niveles de oxígeno, lo que ocurre, por ejemplo, cuando una persona está a elevada altitud, aumenta la expresión de EPO y la producción de eritropoyetina. Sin embargo, se desconocía cómo las células detectaban los cambios en los niveles de oxígeno.
Las investigaciones de Gregg Semenza y Sir Peter J Ratcliffe a inicios de los años 90 permitieron identificar un elemento genético regulador, cercano al gen EPO, que es el responsable de que la expresión de EPO sea dependiente de los niveles de oxígeno. Además, ambos investigadores demostraron que la regulación de la expresión de EPO mediada por los niveles de oxígeno se producía en diferentes tipos celulares, lo que apuntaba a un mecanismo general de detección del oxígeno. Hasta el momento se pensaba que las únicas células donde se producía esta respuesta eran las células del riñón e hígado donde se produce EPO.
El equipo de Semenza identificó una proteína que se une al elemento regulador dependiente de hipoxia cuando los niveles de oxígeno son bajos, a la que denominaron HIF, de Factor Inducible por Hipoxia. En estudios posteriores Semenza caracterizó en profundidad la proteína HIF y resolvió que la proteína funciona en un complejo de dos unidades, y que solo una de ellas, HIF-α, es sensible al oxígeno, por lo que esa unidad debía ser la principal reguladora de la respuesta del complejo al oxígeno.
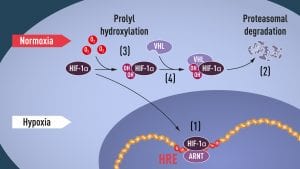
Poco después, diferentes estudios, entre ellos los de Sir Peter J Ratcliffe mostraron que los niveles de HIH-α no varían según la producción de proteína sino que dependen de su estabilidad. Cuando los niveles de oxígeno son normales, la maquinaria celular de degradación de proteínas etiqueta a HIF-α como molécula a degradar y la proteína es digerida rápidamente, por lo que las células contienen muy poca. Sin embargo, en situaciones de hipoxia, HIF-α está protegida de la degradación por lo que sus niveles en la célula aumentan y puede activar la expresión de EPO.
El trabajo de William Kaelin fue esencial para descubrir por qué HIF-α se etiqueta o no para su degradación en función de los niveles de oxígeno. La investigación de Kaeling estaba enfocada en un síndrome hereditario, la enfermedad von Hippel-Lindau, que aumenta el riesgo a desarrollar ciertos cánceres y está causada por mutaciones en el gen VHL. Kaeling demostró que VHL actúa como gen supresor de tumores y previene el cáncer. Además, estudios posteriores destinados a caracterizar de forma más precisa la función de VHL revelaron dos datos importantes sobre la proteína: estaba relacionada con el control de la hipoxia e intervenía en una función importante para la degradación de proteínas, concretamente en el etiquetado de las proteínas destinadas a ser degradadas.
En 1999 equipo de Ratcliffe demostró que VHL interviene en la degradación de HIF-α por parte del proteasoma. Solo quedaba por saber el papel del oxígeno como elemento regulador de todo el proceso. Finalmente, en 2001, los laboratorios de Ratcliffe y Kaeling demostraron que el oxígeno regula la adición de dos grupos hidroxilo a HIF-α y que ese cambio de conformación en la proteína aumenta su afinidad hacia VHL. Poco después, estudios en los que intervinieron ambos investigadores identificaron las enzimas responsables de esa modificación.
Con todas piezas del puzle sobre la mesa, los investigadores elaboraron el mapa del mecanismo de respuesta al oxígeno. Cuando hay oxígeno, se añaden dos grupos hidroxilo a HIF-α, que se une al complejo de VHL y es degradada rápidamente por el proteosoma celular. Cuando disminuye el oxígeno, la afinidad de HIF-α para unirse a VHL disminuye y HIF-α es protegida de la degradación, por lo que se acumula en el núcleo de la célula, donde puede intervenir en la regulación de genes de respuesta a la hipoxia como EPO.
Relevancia del descubrimiento
Los trabajos de William G. Kaelin Jr., Sir Peter J. Ratcliffe y Gregg L. Semenza permitieron entender, desde un punto de vista molecular, la respuesta fisiológica a los cambios en los niveles de oxígeno. Esta respuesta es un proceso esencial para la adaptación a la altitud, regular el metabolismo durante el ejercicio muscular o controlar la formación de vasos sanguíneos durante el desarrollo, entre otros procesos.
En paralelo, la adaptación a los niveles de oxígeno también es relevante en diferentes situaciones patológicas. Por ejemplo, en muchos tumores se aprovecha de la maquinaria de respuesta al oxígeno para favorecer la formación de vasos sanguíneos o modificar el metabolismo de las células.
Conocer la ruta molecular implicada facilita el desarrollo de tratamientos destinados a regularla en condiciones patológicas. En la actualidad se están realizando estudios clínicos para aumentar la función de HIF-α, a través de la inhibición de las enzimas responsables de unirle hidroxilos.
El de este año no es el primer Premio Nobel relacionado con el oxígeno. El papel de este elemento en la fisiología ya fue protagonista de dos Premios Nobel de Fisiología o Medicina: el otorgado a Otto Warburg en 1931 por descubrir que la que la respiración celular que lleva a la conversión de nutrientes a energía es un proceso enzimático, y el otorgado a Corneille Heymans en 1938 por revelar un mecanismo fisiológico mediante el que nuestro organismo puede detectar los niveles de oxígeno en sangre. Heymans demostró que los cuerpos carotídeos, estructuras situadas a ambos lados del cuello, contienen células que actúan como sensores del oxígeno de la sangre.
Fuentes:
Press release: The Nobel Prize in Physiology or Medicine 2019. https://www.nobelprize.org/prizes/medicine/2019/press-release/
Scientific Background. https://www.nobelprize.org/prizes/medicine/2019/advanced-information/
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos. Tienes más información aquí.

