Amparo Tolosa, Genética Médica News

El sistema CRISPR de edición del genoma se ha convertido en una de las herramientas biotecnológicas más conocidas de los últimos tiempos. Derivado de un mecanismo de defensa con el que las bacterias hacen frente a las infecciones víricas, su potencial para introducir cambios en el genoma de forma específica ha ido convirtiéndose en una realidad, al tiempo que aparecían nuevas aplicaciones más allá de la de editar el ADN, como la posibilidad de modificar el ARN o la metilación del genoma.
El sistema CRISPR de edición genómica básico consta de dos elementos, un ARN guía que reconoce la secuencia del genoma a modificar y una enzima nucleasa que corta el ADN donde el ARN guía la ha posicionado. Una vez generado un punto de rotura en el ADN, los sistemas de reparación de la célula son activados para repararlo. Cuando se pretende inactivar un gen, generando una pequeña deleción o inserción de pares de bases en el ADN, la edición del genoma depende de que los mecanismos de reparación cometan errores. Si lo que se quiere es introducir un cambio concreto, lo más habitual es incorporar al coctel de componentes un fragmento de ADN con el cambio que se desea que actúe de molde para los mecanismos de reparación.
Hasta el momento existían dos sistemas CRISPR, cada uno de ellos con una nucleasa diferente y unos requerimientos de molécula de ARN guía concretos. En los últimos días, dos de los principales laboratorios de investigación en CRISPR han presentado sendos nuevos miembros de la familia de editores genéticos, CRISPR-Cas12b y CRISPR-CasX, que muestran ventajas sobre los CRISPR existentes. El desarrollo de los nuevos CRISPR pone de manifiesto el interés en optimizar los sistemas de edición del genoma y refleja el gran potencial de la naturaleza para proporcionar nuevos componentes en los mismos.
En primer lugar, un equipo de investigadores del Instituto Broad del Instituto de Tecnología de Massachusetts ha introducido el sistema de edición genómica CRISPR-Cas12b como una estrategia alternativa a utilizar en células humanas más eficiente que los otros CRISPR. El trabajo, publicado en Nature Communications, proporciona además una pauta de trabajo con la que obtener nuevas nucleasas eficaces para modificar el genoma, además de mostrar que puede existir una amplia diversidad de sistemas CRISPR por descubrir.
El equipo, del que forma parte Feng Zhang, uno de los primeros promotores de la utilización de CRISPR como herramienta para modificar el genoma, acaba de demostrar que se puede optimizar una enzima para ser utilizada como uno de los componentes principales de CRISPR incluso con mayor especificidad que los sistemas anteriores.
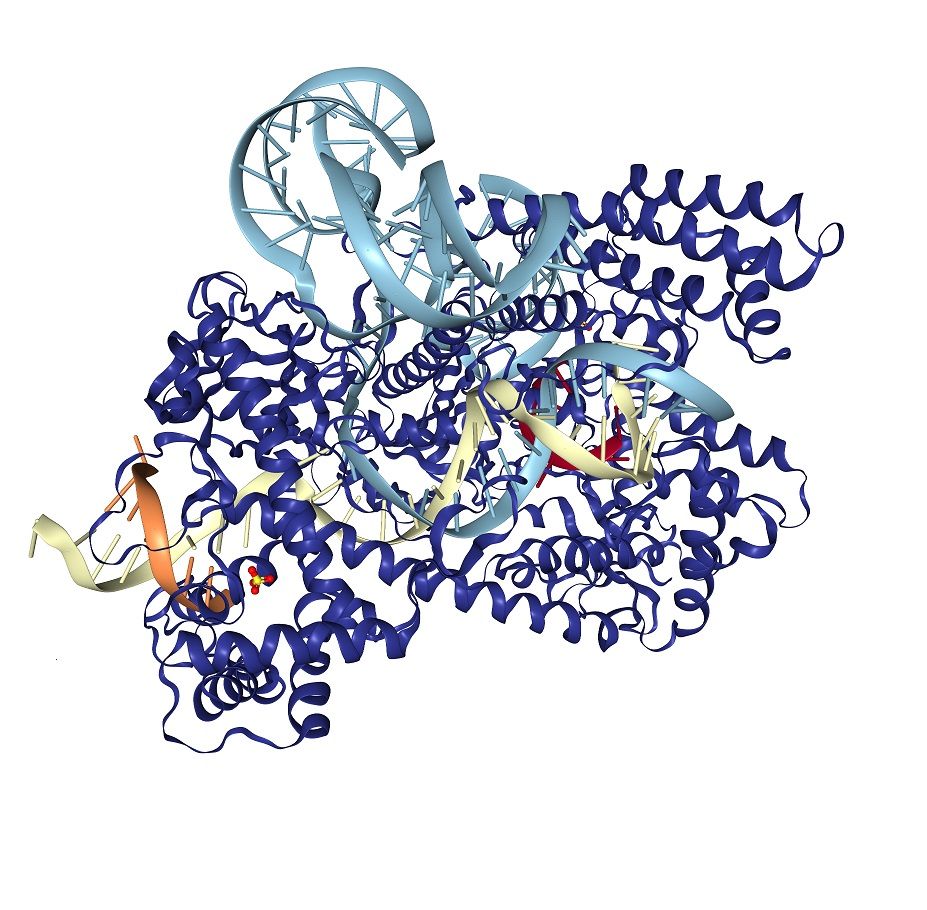
Los investigadores partían de un estudio previo en el que habían identificado a la enzima Cas12b (conocida entonces como C2c1) como nueva candidata a formar parte de la familia de sistemas CRISPR. Sin embargo, Cas12b tenía un inconveniente: había sido aislada de una bacteria termófila y su tempera óptima para funcionar era de 48ºC, mucho mayor de la temperatura de los organismos cuyo ADN puede ser interesante modificar, entre ellos las células humanas.
El equipo se planteó entonces el objetivo de identificar una enzima Cas12b que pudiera trabajar a temperaturas más bajas. Para ello, en primer lugar, utilizaron la secuencia del gen que codifica Cas12b en la bacteria termófila y rastrearon las bases de datos conocidas, hasta encontrar 27 miembros de la familia Cas12b presentes en otras bacterias. Los investigadores seleccionaron 14 que no habían sido descritas previamente y no procedían de bacterias termófilas y evaluaron su capacidad para ser utilizadas en un sistema CRISPR. Dos de ellas mostraron potencial por lo que los investigadores probaron y diseñaron ARNs guía para optimizar su funcionamiento, perfeccionando significativamente el de una de ellas, la nucleasa Cas12b obtenida de Bacilus hisashii. Sin embargo, la enzima, tal y como se presentaba en la naturaleza a 37ºC cortaba la cadena errónea de ADN por lo que el equipo decidió modificarla para superar esta limitación.
A partir del análisis de la secuencia de la enzima los investigadores identificaron posibles cambios que mejoraran su actividad a temperaturas más acordes a las células de mamífero y crearon una enzima modificada con la que pudieron editar con éxito el genoma de diversas líneas celulares humanas, así como linfocitos T extraídos de la sangre. Los resultados muestran que la nueva versión de Cas12b muestra mayor especificidad para modificar las células humanas que la conocida Cas9.
“Buscamos inspiración a partir de la naturaleza”, señala Zhang. “Queríamos crear una versión de Cas12b que pudiera operar a bajas temperaturas, por lo que rastreamos miles de secuencias genéticas de bacterias buscando en bacterias que podrían sobrevivir a las bajas temperaturas de los ambientes de mamíferos”.
Esta es la segunda Cas12b que muestra resultados positivos para la modificación del genoma de mamíferos (un estudio del pasado noviembre mostraba que una Cas12b extraída de la bacteria Alicyclobacillus acidiphilus podía ser utilizada también para introducir cambios en el ADN de mamíferos) y la primera en mostrar potencial y eficacia en la modificación del genoma humano.
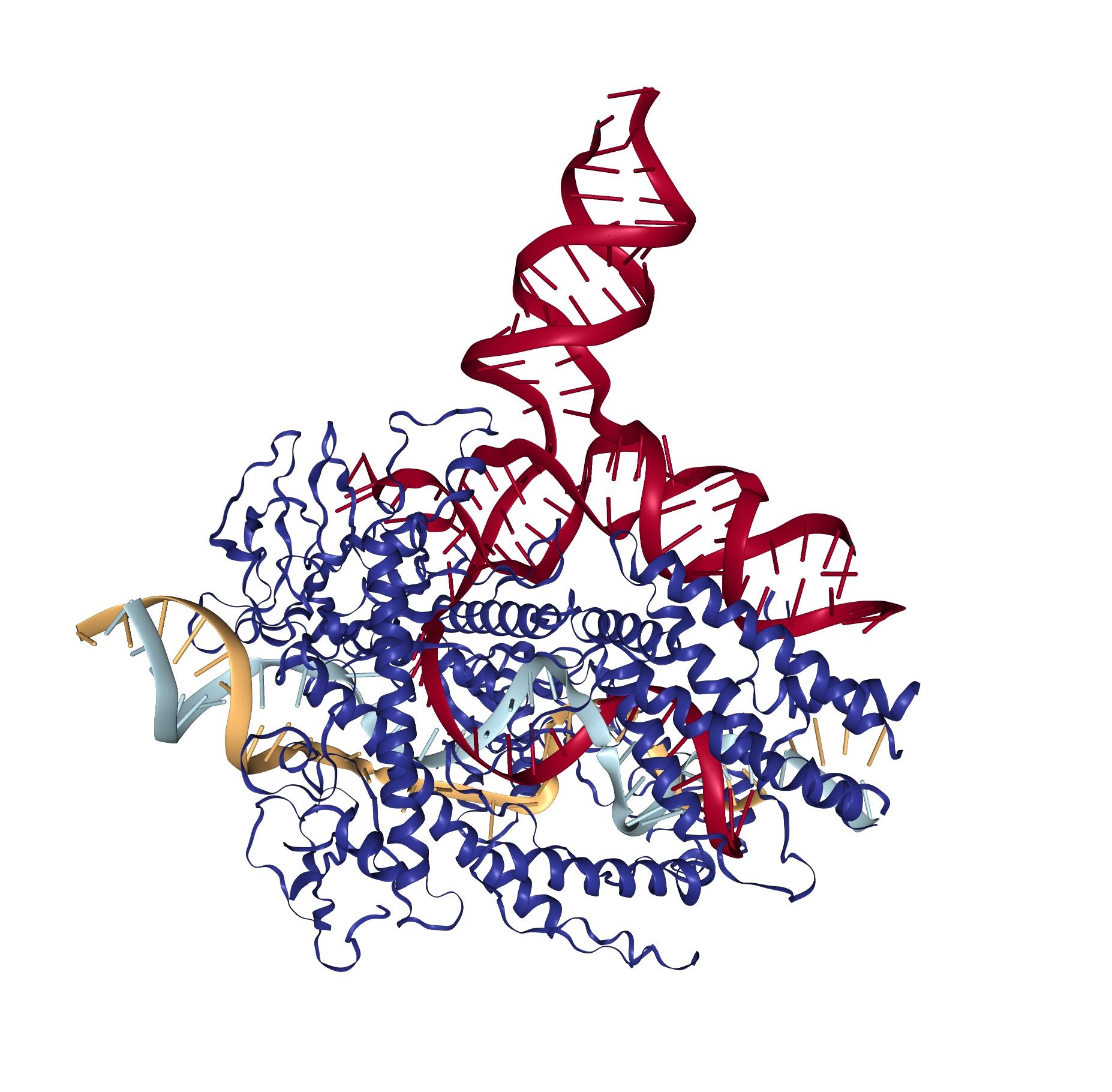
Los siguientes miembros de la familia CRISPR presentados recientemente forman por si solos una familia, la de las enzimas CasX. Estos nuevos editores genómicos han sido presentados por el equipo de Jennifer Doudna, pionero en la edición genómica mediante CRISPR. En un trabajo publicado en Nature, los investigadores describen CasX como sistemas de edición genómica guiados por ARN eficientes, tanto en bacterias como en células humanas.
El equipo ya había identificado las proteínas CasX hace dos años. No obstante, hasta el momento no se había evaluado en profundidad su capacidad como herramienta de edición del genoma en un sistema diferente al de las bacterias en las que se había identificado. El nuevo estudio indica que CRISPR-CasX puede ser utilizado tanto en la conocida bacteria Escherichia coli como en células humanas, lo que apunta a una amplia diversidad en el número de organismos que podrían modificarse mediante este sistema.
Los investigadores presentan como principal ventaja de CasX su pequeño tamaño, lo que la hace perfecta para poder introducir la información necesaria para producirla en las células cuyo ADN se desea modificar. Además, El análisis de la estructura de CasX y las imágenes que han tomado los investigadores de cómo interacciona con el ADN y cómo es capaz de introducir cortes específicos en la cadena de ADN, indican que la proteína ha evolucionado de forma independiente a Cas9 o Cas12 y no comparte un ancestro común con ellas.
“Lo primero que llama la atención es cómo dominios tan únicos cumplen papeles similares a los que hemos visto con otras proteínas de unión al ADN guiadas por ARN”, señala Benjamin Oakes, uno de los autores del trabajo. “El tamaño mínimo de CasX ayuda a demostrar claramente que hay una receta básica que la naturaleza utiliza. Entender esta receta nos ayudará a evolucionar mejor y diseñar herramientas de edición del genoma para nuestros propósitos como si fuera la naturaleza”.
Otra ventaja que presenta CasX, que sí comparte con Cas12b, es que las bacterias de las que derivan no están presentes en humanos, por lo que es poco probable que exista una inmunidad previa a las proteínas, que pueda desencadenar una respuesta inmunitaria no deseada a la hora de utilizar CRISPR con pacientes.
El sistema CRISPR de edición del genoma ha surgido, como muchas otras tecnologías, a partir de la transformación de un proceso que ocurre en la naturaleza en una herramienta de laboratorio dirigida con una aplicación concreta. Desde que en 2012 se planteó la utilidad del mecanismo de defensa bacteriano identificado por Francisco Mójica como base con la que diseñar una plataforma para editar el genoma, las aplicaciones técnicas y las posibilidades de esta nueva biotecnología no han parado de evolucionar. Cas12by CasX se unen así a una familia con gran versatilidad para transformar la biotecnología y la medicina. Una familia que está creciendo y en la que, en palabras de Jennifer Doudna “No buscamos simplemente el siguiente par de tijeras. Queremos construir la próxima navaja suiza”.
Referencias:
Strecker J, et al. Engineering of CRISPR-Cas12b for human genome editing. Nat Com. 2019. Doi: https://doi.org/10.1038/s41467-018-08224-4
Liu JJ, et al. CasX enzymes comprise a distinct family of RNA-guided genome editors. Nature. 2019. Doi: https://doi.org/10.1038/s41586-019-0908-x
Fuentes:
Scientists engineer new CRISPR platform for DNA targeting. http://news.mit.edu/2019/scientists-engineer-crispr-cas12b-dna-targeting-0122
Scientists find new and smaller CRISPR gene editor: CasX. https://news.berkeley.edu/story_jump/scientists-find-new-and-smaller-crispr-gene-editor-casx/