José Manuel Valdivielso1 y Ramiro Jover2
1Experimental Nephrology Laboratory, IRB Lleida, Lleida.
2Experimental Hepatology Unit, IIS Hospital La Fe & Dep. Biochemistry and Molecular Biology, University of Valencia.
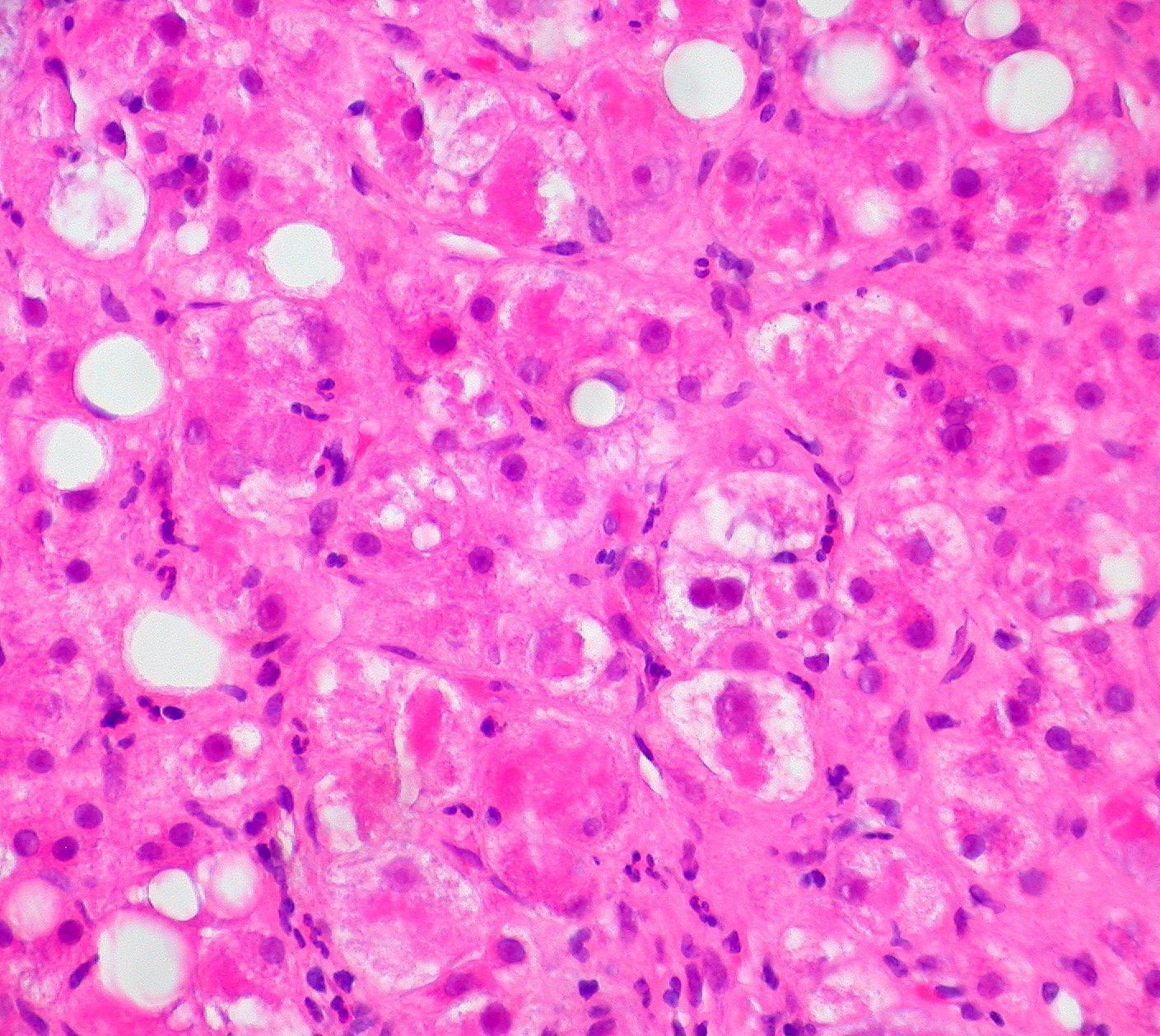
La enfermedad del hígado graso no alcohólico (EHGNA) abarca a un grupo de afecciones en las que el denominador común es la acumulación excesiva de grasa dentro del hígado (esteatosis) en personas que consumen poco alcohol o nada.
Estos pacientes pueden presentar una esteatosis simple, que se podría considerar benigna, ya que dicha grasa bien controlada no debería dañar al hígado. Sin embrago, un porcentaje de los pacientes presentan una afección más grave, llamada esteatohepatitis no alcohólica (EHNA), en la que la esteatosis se presenta junto con inflamación hepática y diferentes grados de fibrosis. La EHNA sí que es una afección grave, capaz de derivar a cirrosis, cuando el hígado acumula lesiones y tejido fibroso, lo que conduce a que el hígado sea incapaz de funcionar adecuadamente. Algunos pacientes que desarrollan cirrosis terminan necesitando un trasplante de hígado.
La EHGNA es la enfermedad hepática más frecuente en el mundo y la causa más común de alteraciones en las pruebas de funcionalidad hepática en Estados Unidos. En las últimas décadas la prevalencia de la EHGNA se ha incrementado considerablemente afectando en algunos países a casi un tercio de la población. Además, en pacientes con sobrepeso y obesidad la enfermedad aparece hasta en un 80 % de los casos. La EHGNA también se observa muy frecuentemente en pacientes con síndrome metabólico, caracterizado por diabetes o prediabetes (resistencia a la insulina), sobrepeso u obesidad, dislipemia (niveles elevados de colesterol y triglicéridos) e hipertensión.
Los mecanismos que conducen al EHGNA todavía no se conocen completamente, pero las evidencias encontradas apoyan múltiples mecanismos y factores de riesgo. Hay numerosos condicionantes aceptados, como el estilo de vida sedentario, la dieta no equilibrada, el exceso de calorías, las variantes genéticas, los medicamentos, etc. que favorecen la disfunción de diversas rutas metabólicas y el incremento de ácidos grasos libres en el torrente circulatorio; los cuales terminan por acumularse en las células del hígado donde provocan múltiples alteraciones fisiopatológicas. Recientemente se ha demostrado que en este proceso de captación y acumulación de grasa en el hígado intervienen algunos factores de transcripción de la familia de los receptores nucleares, como PPARα, PPARγ, LXR o FXR.
Estos hallazgos han despertado el interés en los receptores nucleares como posibles factores implicados en la patogénesis de la EHGNA y también como potenciales dianas terapéuticas. Sin embargo, hasta ahora no se había prestado atención a un importante miembro de esta familia: el receptor de vitamina D (VDR).
El VDR media los efectos biológicos de la vitamina D a través de la activación de diversos genes. El VDR es abundante en el intestino, los riñones, los huesos y la glándula paratiroidea donde se activa por la vitamina D para controlar la homeostasis del calcio y el fósforo. Pero en realidad el VDR está presente en casi todas las células lo que sugiere una función más amplia.
En el hígado, el posible papel del VDR ha pasado desapercibido durante mucho tiempo debido a que su concentración es muy baja en los hepatocitos, las células principales del hígado. Sin embargo, aunque a baja concentración, el VDR está allí y puede activar varios genes relacionados con el metabolismo de los ácidos biliares. De hecho uno de estos ácidos biliares es capaz de unirse y activar al VDR, de un modo similar a la vitamina D. Esto nos indicaba que el VDR también puede ser relevante en la fisiología y patología del hígado. De hecho las alteraciones en la expresión de VDR, que son importantes en numerosas enfermedades; también son críticas para algunos trastornos hepáticos tales como cirrosis biliar primaria y la hepatitis autoinmune. Sin embargo, un posible papel de VDR en otras patologías hepáticas prevalentes, como la EHGNA no se había investigado nunca.
En el presente estudio hemos demostrado por primera vez que la expresión del VDR aumenta en los hepatocitos de los hígados con EHGNA.
En primer lugar medimos los niveles de VDR en el hígado de dos modelos animales de EHGNA: ratones apoE knockout (KO) con dieta rica en grasa y ratones de tipo salvaje con dieta deficiente en metionina y colina. También investigamos los niveles de VDR en pacientes con la distintos estadíos de la enfermedad: hepatosteatosis simple y esteatohepatitis. La expresión de VDR se indujo notablemente en el hígado de los dos modelos de ratón, así como en pacientes con hepatosteatosis, pero disminuyó en la esteatohepatitis.
Para valorar la relevancia del VDR en estas condiciones inducidas hemos delecionado el gen VDR en ratones y observado que en estas circunstancias sus hígados no acumulan gasa y no se ponen enfermos, lo que indica que, efectivamente, el VDR inducido en la EHGNA desempeña un papel clave en la aparición de la enfermedad. En concreto, la deleción de VDR en ratones apoE KO con una dieta rica en grasa protegió contra el hígado graso, la dislipemia y la resistencia a la insulina, y provocó una disminución de los ácidos biliares plasmáticos. El papel de VDR en la fibrosis se determinó también en ratones VDR KO tratados con tioacetamida, pero observamos que la ausencia de VDR no influía en la fibrosis.
El análisis del mecanismo molecular nos ha indicado que la promoción de la esteatosis por VDR resulta de la activación de rutas metabólicas para la síntesis y acumulación de lípidos, y de la inhibición de vías para oxidar y eliminar la grasa en los hepatocitos. Así pues, los hígados de los ratones apoE KO & VDR KO mostraron disminución de la expresión de genes lipogénicos (CD36, DGAT2, C/EBPα, PPARγ), y aumento de la expresión de genes de movilización y oxidación de grasas (PNPLA2, LIPIN1, PGC1α).
La relevancia de VDR también se evaluó en ratones apoE KO con dieta rica en grasa mediante tratamiento con paricalcitol, y en células HepG2 humanas por transfección o silenciamiento del VDR. El tratamiento con paricalcitol tuvo efectos opuestos (a la deleción del VDR) sobre la esteatosis y la expresión génica. Por último, este conjunto de genes mostraron respuestas concordantes cuando VDR se sobreexpresó o se silenció en las células hepáticas humanas HepG2.
La interpretación de estos resultados en el contexto biológico podría tener varias lecturas. En primer lugar, aunque es cierto que en los animales sin VDR no se produjo acumulación de grasa en el hígado tras la dieta alta en grasa, estos presentaban unos niveles de aterosclerosis más elevados que los animales que sí tenían VDR. Parece por tanto, que la presencia del VDR en el hígado sería un mecanismo protector para el resto del organismo contra el exceso de grasa en la dieta. Sin embargo, el precio a pagar en dietas crónicas con alto contenido en grasa sería una acumulación excesiva en el hígado y la aparición de esteatosis. Otra visión podría estar relacionada con la capacidad de los mamíferos de detectar las condiciones climáticas más apropiadas para crecer y engordar. En periodos estivales con elevada radiación solar, los niveles de vitamina D aumentarían y por tanto también se captaría más calcio y fósforo y se acumularía más grasa en tejido adiposo y en hígado en previsión de tiempos peores. En los inviernos, con menos horas de luz solar y niveles de vitamina D más bajos, la menor activación del VDR provocaría un aumento de la actividad de UCP1 que ‘quemaría’ la grasa para mantener la temperatura corporal.
En resumen, hemos descubierto que la concentración del receptor VDR aumenta en los hepatocitos en una etapa temprana del desarrollo de la EHGNA, tanto en los hígados de los ratones modelo como en los seres humanos con la enfermedad. Si se elimina el VDR, hay cambios importantes en el metabolismo de los lípidos en los hepatocitos y no se acumula grasa en el hígado. Llegamos a la conclusión de que el receptor VDR promueve la EHGNA y sugerimos que su modulación o inhibición (terapéutica) selectiva en el hígado podría revertir esta enfermedad en sus inicios.
Referencia: Bozic M, et al. Hepatocyte vitamin D receptor regulates lipid metabolism and mediates experimental diet-induced steatosis. J Hepatol. 2016 May 28. doi: http://dx.doi.org/10.1016/j.jhep.2016.05.031