Amparo Tolosa, Genética Médica News
La piel humana constituye la primera barrera de protección de gran parte de nuestro organismo. Cuando se produce una herida, la piel se regenera. Es decir, se inician una serie de procesos que cierran la herida, eliminan el material dañado, previenen la infección y reconstruyen la estructura de las diferentes capas de la piel. En estos procesos intervienen diversos tipos celulares, como las células inmunitarias responsables de evitar posibles infecciones y eliminar restos celulares de la zona dañada, o las células epiteliales de zonas adyacentes, que proliferan y migran hacia la zona dañada para restaurar su estructura.

En general, las heridas de la piel tardan unas pocas semanas en sanar. Sin embargo, en algunas situaciones los mecanismos de regeneración de la piel no funcionan correctamente y pueden formarse heridas crónicas (conocidas como úlceras) o un exceso de tejido cicatricial. La presencia de problemas vasculares y la diabetes son las principales causas de este tipo de heridas, que afectan a la calidad de vida y pueden llegar a poner en riesgo vital a los pacientes. No obstante, otros factores como la edad o un sistema inmunitario comprometido, también contribuyen a que la capacidad de regeneración de la piel disminuya.
El tratamiento habitual de las úlceras es la realización de trasplantes de piel en la zona afectada. Esta aproximación presenta algunas limitaciones, especialmente cuando las heridas son de gran tamaño y es necesario recurrir a cultivos de células de los pacientes para obtener suficiente piel para realizar injertos. Por esta razón existe una necesidad de desarrollar nuevas estrategias terapéuticas dirigidas a regenerar la piel.
Un equipo de investigadores del Instituto Salk dirigido por Juan Carlos Izpisua Belmonte, en colaboración con Masakazu Kurita investigador asociado del mismo centro, se ha planteado si sería posible conseguir regenerar la piel directamente, in vivo, sin realizar injertos de piel. Los investigadores se preguntaron si sería posible aumentar el número de células progenitoras de la piel en las heridas. ¿Cómo? Reprogramando otras células que abundan en las heridas.

En un primer paso, los investigadores compararon la expresión de los fibroblastos de la piel (las células que querían reprogramar) con la de las células epiteliales con capacidad regenerativa responsables de regenerar la piel. De este modo identificaron diferentes factores que podían intervenir en la reprogramación de los fibroblastos a células progenitoras de la piel. A continuación, a partir de diferentes experimentos con combinaciones de estos factores, el equipo determinó que la presencia de cuatro de ellos (DNP63A, GRHL2, TFAP2A y MYC) era suficiente para llevar a cabo la reprogramación.
El siguiente paso de los investigadores fue confirmar, primero en tejido y después en ratones, que el tratamiento con virus que incluían la información genética para producir los cuatro factores identificados permitía regenerar el tejido epitelial y curar las heridas. El equipo observó que la reprogramación de las células conseguía restaurar estructural y funcionalmente la piel. Además, cuando los virus se administraban sobre la herida en combinación con un gel de colágeno y ciertas moléculas bioactivas, la especificidad y rendimiento del sistema mejoraban.
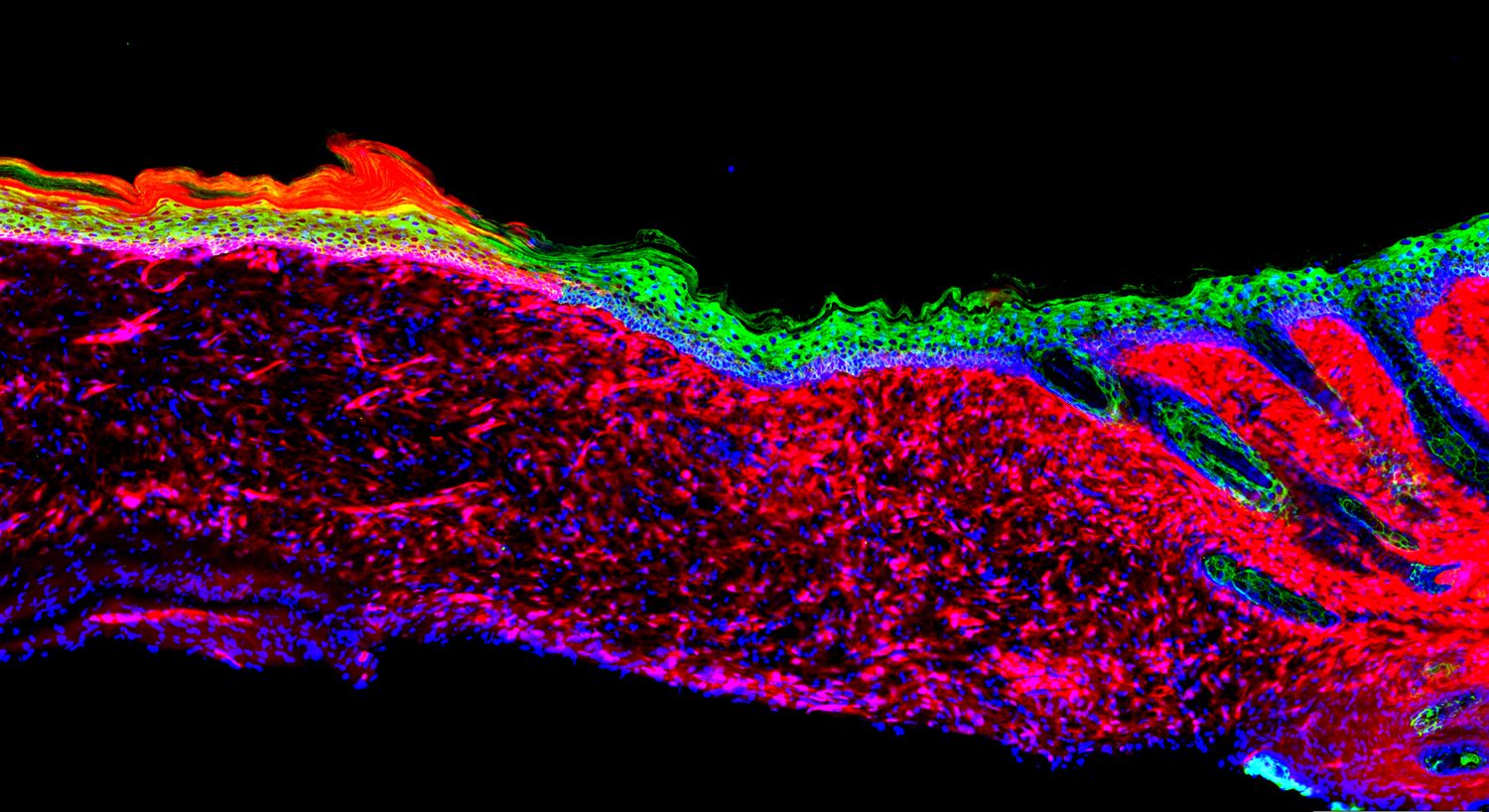
Los resultados del trabajo ofrecen una estrategia para generar tejido epitelial in vivo, a partir de la reprogramación de células residentes en las heridas. La capacidad regenerativa de la piel no solo disminuye en determinadas condiciones médicas, sino que también se ve comprometida por factores como la edad, algo ineludible, o ciertos estados fisiológicos. Así, la posibilidad de regenerar tejido epitelial in vivo podría tener importantes aplicaciones para la práctica clínica y la medicina regenerativa, más allá del tratamiento de heridas. Antes, sin embargo, los investigadores reconocen que deberá realizarse una optimización del método respecto a su eficiencia para regenerar el tejido epitelial o a la administración de la terapia en humanos, así como diferentes estudios que confirmen que la aproximación es segura para los pacientes.
“Nuestras observaciones constituyen una prueba inicial de principio para la regeneración in vivo de un tejido tridimensional como la piel y no tipos celulares individuales, como se había mostrado antes”, señala Juan Carlos Izpisúa Belmonte, director del trabajo. “Este conocimiento podría ser útil no solo para mejorar la reparación de la piel sino también para guiar estrategias regenerativas in vivo en otras situaciones patológicas humanas, como el envejecimiento en el que la reparación del tejido está alterada”.
Investigación original: Kurita M, et al. In vivo reprogramming of wound-resident cells generates skin epithelial tissue. Nature. 2018. Doi: https://doi.org/10.1038/s41586-018-0477-4
Fuente: The alchemy of healing: researchers turn open wounds into skin. https://www.salk.edu/news-release/the-alchemy-of-healing-researchers-turn-open-wounds-into-skin/



