Maria Gomis-González 1, Arnau Busquets-Garcia 1,†, Carlos Matute 2,3,4, Rafael Maldonado 1, Susana Mato 2,3,4 and Andrés Ozaita 1
1 Laboratorio de Neurofarmacología NeuroPhar, Departamento de Ciencias Experimentales y de la Salud, Programa de Genética y Neurociencia, Universitat Pompeu Fabra, Barcelona, España
2 Departamento de Neurociencias, Universidad del País Vasco UPV/EHU, Leioa, España
3 Achucarro Basque Center for Neuroscience, Zamudio, España
4 Centro de Investigación Biomédica en Red de Enfermedades Neurodegenerativas (CIBERNED), Madrid 28031, España
† Afiliación actual: Endocannabinoids and Neuroadaptation Group, NeuroCentre Magendie, INSERM U1215, Burdeos, Francia.
El síndrome del cromosoma X frágil (SXF) es la forma más común de discapacidad intelectual heredada y la causa monogénica más frecuente entre los trastornos del espectro autista (De Vries et al, 1998). En la mayoría de casos conocidos, la mutación causante de la enfermedad es la expansión de un trinucleótido CGG en la región promotora del gen FMR1 (fragile X mental retardation 1). Cuando el número de copias de este trinucleótido es superior a 200 se produce una hipermetilación que, a su vez, produce que sea silenciado el gen y que se produzca una pérdida de expresión de la proteína FMRP (fragile X mental retardation protein). La ausencia de esta proteína conduce a las manifestaciones clínicas que definen el síndrome (Verkerk et al, 1991; Darnell et al, 2011).
Un estudio previo de nuestro grupo de investigación (Busquets-García et al, 2013) demostró que el sistema endocannabinoide puede ser una buena diana terapéutica para el tratamiento del SXF. En este estudio se demostró que en un modelo de ratón en el que se elimina el gen Fmr1 murino (el modelo Fmr1 knockout, Fmr1 KO) (Bakker et al, 1995), la administración de rimonabant, un antagonista/agonista inverso del receptor cannabinoide CB1, a una dosis de 1 mg/kg era capaz de reducir algunos de los fenotipos presentes en el ratón tales como el déficit cognitivo, la incrementada susceptibilidad a sufrir crisis epilépticas audiogénicas, la sensibilidad reducida al dolor o las anomalías a nivel de las espinas dendríticas neuronales.
En el presente estudio hemos analizado la posibilidad de reducir las dosis de rimonabant usadas en el estudio anterior (Busquets-García, et al 2013) así como de usar otra molécula con perfil antagonista neutro sobre el receptor cannabinoide CB1. El hecho de disminuir las dosis de rimonabant es relevante dado que este fármaco había sido previamente comercializado para el tratamiento de la obesidad, pero fue posteriormente retirado del mercado debido a la aparición de efectos adversos psiquiátricos (principalmente cambios de humor e ideación suicida) en un porcentaje de la población tratada. Las dosis usadas para la pérdida de peso eran altas (Martín-García et al, 2010) comparadas con las dosis necesarias para obtener mejoras en el modelo animal del síndrome del cromosoma X frágil (Busquets-García et al, 2013). De hecho, el presente estudio muestra que una dosis hasta diez veces menor de rimonabant (0.1 mg/kg) que la empleada en nuestro estudio anterior, administrada durante 7 días, sigue siendo efectiva para normalizar el déficit cognitivo en el ratón Fmr1 KO.
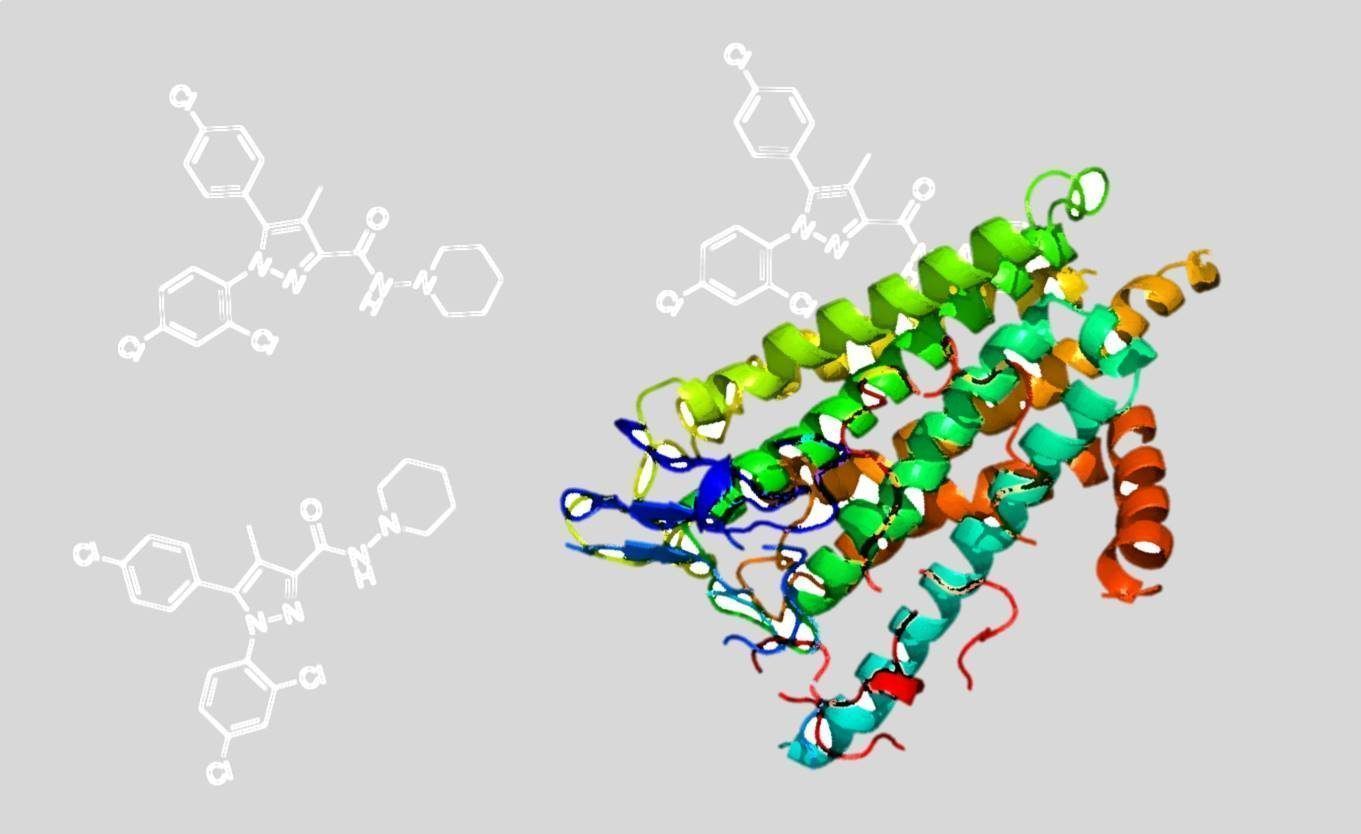
De la misma manera, un protocolo de administración del rimonabant en días alternos (7 dosis en 14 días) demostró el mismo efecto terapéutico. Por otro lado, el uso de NESS0327 (N-piperidinyl-[8-chloro-1-(2,4dichlorophenyl)1,4,5,6tetrahydrobenzo[6,7] cyclohepta[1,2-c]pyrazole-3-carboxamide), un antagonista neutro del receptor CB1 (Ruiu et al, 2003), administrado durante 7 días también normalizó el déficit cognitivo en el ratón Fmr1 KO, indicando que el hecho de bloquear parcialmente la actividad del receptor cannabinoide CB1 es suficiente para producir mejoras cognitivas.
Otro fenotipo característico del ratón Fmr1 KO es el incremento en una forma de plasticidad sináptica conocida como “depresión a largo plazo” (long-term depression o LTD) dependiente de los receptores metabotrópicos de glutamato del grupo I en el hipocampo (Bear et al, 2004), cambio que se ha asociado a los déficits cognitivos. Dicha alteración de la plasticidad sináptica responde a otros tratamientos que se han ensayado con éxito en el mismo modelo murino (Michalon et al, 2012). En el presente estudio, y mediante aproximaciones eletrofisiológicas, hemos demostrado que la función sináptica se normaliza en el ratón Fmr1 KO mediante el mismo tratamiento con rimonabant que mejora la función cognitiva.
En resumen, nuestros resultados muestran cómo el bloqueo del receptor CB1 con dosis de rimonabant hasta 30 veces más bajas que aquellas en las que se reportaron efectos adversos neuropsiquiátricos, tiene efectos beneficiosos sobre los déficits cognitivos presentes en el modelo murino del SXF, los cuales están asociados a la normalización de la plasticidad sináptica. Investigaciones futuras determinarán si esta aproximación farmacológica puede ser beneficiosa en otros desórdenes genéticos que cursan con discapacidad intelectual.
Referencia: Gomis-González M, et al. Possible Therapeutic Doses of Cannabinoid Type 1 Receptor Antagonist Reverses Key Alterations in Fragile X Syndrome Mouse Model. Genes (Basel) 2016 Aug 31; 7(9). doi: 10.3390/genes7090056.
Bibliografía:
Bakker CE et al. Fmr1 knockout mice: a model to study fragile X mental retardation. The Dutch-Belgian Fragile X Consortium. Cell. 1994 Jul 15;78(1):23-33. http://dx.doi.org/10.1016/0092-8674(94)90569-X
Bear MF, et al. The mGluR theory of fragile X mental retardation. Trends Neurosci. 2004 Jul;27(7):370-7. Doi: http://dx.doi.org/10.1016/j.tins.2004.04.009
Busquets-Garcia A, et al. Targeting the endocannabinoid system in the treatment of fragile X syndrome. Nat Med. 2013 May;19(5):603-7. doi: 10.1038/nm.3127.
Darnell JC, et al. FMRP stalls ribosomal translocation on mRNAs linked to synaptic function and autism. Cell. 2011 Jul 22;146(2):247-61. doi: 10.1016/j.cell.2011.06.013.
Martín-García E, et al. Central and peripheral consequences of the chronic blockade of CB1 cannabinoid receptor with rimonabant or taranabant. J Neurochem. 2010 Mar;112(5):1338-13351. doi: http://dx.doi.org/10.1111/j.1471-4159.2009.06549.x.
Michalon A, et al. Chronic pharmacological mGlu5 inhibition corrects fragile X in adult mice. Neuron. 2012 Apr 12;74(1):49-56. doi: http://dx.doi.org/10.1016/j.neuron.2012.03.009
Ruiu S, et al. Synthesis and characterization of NESS 0327: a novel putative antagonist of the CB1 cannabinoid receptor. J Pharmacol Exp Ther. 2003 Jul;306(1):363-70. Doi: http://dx.doi.org/10.1124/jpet.103.049924
Verkerk AJ, et al. Identification of a gene (FMR-1) containing a CGG repeat coincident with a breakpoint cluster region exhibiting length variation in fragile X syndrome. Cell. 1991 May 31;65(5):905-14. Doi: http://dx.doi.org/10.1016/0092-8674(91)90397-H
Vries BB, et al. The fragile X syndrome. J Med Genet. 1998 Jul;35(7):579-89. Review.
Fuente: El rimonabant, posible tratamiento para el síndrome del cromosoma X frágil. https://portal.upf.edu/web/media/inici/-/asset_publisher/O4zdexb3VIVd/content/id/5963989#.V-jv0PmLTcs
