Amparo Tolosa, Genética Médica News
Un estudio publicado el pasado viernes en la plataforma bioRxiv acaba de revelar lo que podría convertirse en un importante obstáculo para la edición del genoma mediante la tecnología CRISPR con fines terapéuticos: el sistema inmunitario de algunas personas está preparado para atacar uno de los componentes principales de CRISPR.

En los últimos años hemos asistido al crecimiento de la tecnología CRISPR como una herramienta fundamental para conseguir modificar el genoma humano y tratar enfermedades genéticas. Numerosos estudios han demostrado cómo el sistema CRISPR puede ser utilizado para introducir cambios de forma precisa en el genoma y corregir errores en el ADN responsables de causar enfermedades, e incluso ya han comenzado los primeros ensayos clínicos en los que se utiliza CRISPR como parte de tratamiento contra el cáncer de pulmón.
La tecnología CRISPR consta de dos componentes principales, una enzima nucleasa que corta el ADN y un ARN que guía a la enzima a la posición del genoma que debe cortar. La nucleasa utilizada de forma más frecuente en el sistema CRISPR es Cas9 derivada principalmente de Staphylococcus aureus o Stretptococcus pyogenes, bacterias comunes que están presentes en muchas personas y pueden, en ocasiones, provocar infecciones patológicas.
Algunos estudios previos ya habían mostrado la presencia de anticuerpos frente a ambas bacterias en un 100% de las personas adultas, sin embargo se desconocía si existía también una inmunidad específica frente a las proteínas Cas9 de ambas bacterias, lo que podría comprometer en el futuro la efectividad de los tratamientos con CRISPR.
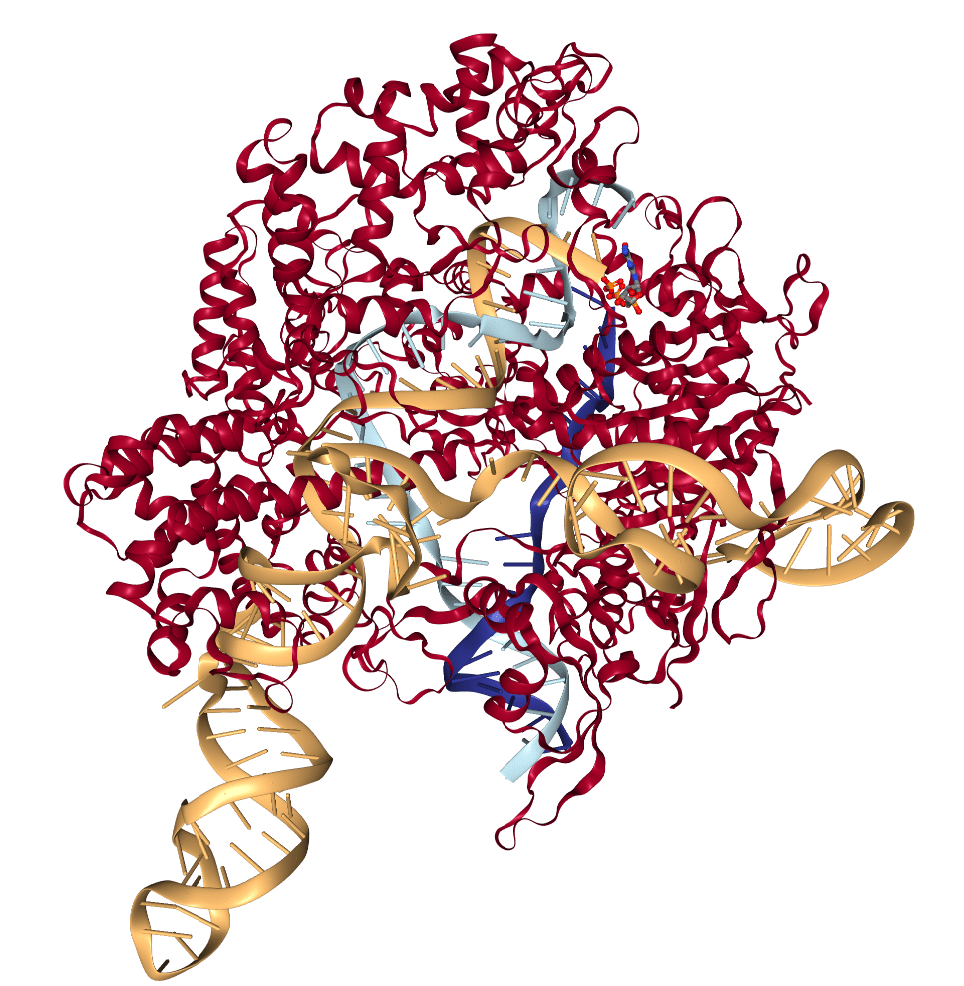
Un equipo de investigadores de la Universidad de Stanford, dirigido por Matthew Porteus, ha analizado la presencia de anticuerpos frente a las proteínas Cas9 de bacterias Staphylococcus aureus o Stretptococcus pyogenes (denominadas SaCas9 y Spcas9 respectivamente) en el suero de 22 recién nacidos y 12 adultos y ha encontrado que el 79% de las personas analizadas tienen anticuerpos frente a SaCas9 y el 65% de ellas presentan anticuerpos frente a la SpCas9. La presencia de anticuerpos frente a ambas proteínas Cas9 bacterianas indica la existencia de una inmunidad humoral, fruto de exposiciones previas a las bacterias, que probablemente haya ocurrido tras el nacimiento, señalan los autores del trabajo.
Respecto a la inmunidad celular, mediada, principalmente por linfocitos T, el equipo ha detectado linfocitos T dirigidos frente a SaCas9 en el 46% de las 13 personas en las que ha analizado su presencia. Los investigadores no encontraron linfocitos T que reconocieran SpCas9. Sin embargo, no descartan que pueda haberlos ya que el reducido tamaño de la muestra y las limitaciones propias de la técnica utilizada podrían haber impedido su detección.
Los resultados del trabajo indican que una proporción importante de la población humana podría presentar una inmunidad humoral y celular frente a uno de los componentes principales de CRISPR. En principio, este descubrimiento tiene el potencial de convertirse en un gran contratiempo para la utilización de CRISPR como herramienta terapéutica, ya que podría afectar a la eficacia de CRISPR o inducir toxicidad en los pacientes. Por ejemplo, en el caso de existir anticuerpos frente a Cas9 en el paciente, estos podrían unirse a la nucleasa administrada en el tratamiento e impedir que lleve su trabajo de edición genómica. Y la presencia de linfocitos T específicos contra componentes de Cas9 podría hacer que atacaran las células en las que se produce la proteína, que justo son aquellas células en las que se produce la edición genómica terapéutica.
Los investigadores indican que no hay evidencias de que la presencia de anticuerpos frente a Cas9 pueda suponer un problema. En el caso de la inmunidad humoral, las posibilidades de contacto y reconocimiento de Cas9 por parte de los anticuerpos presentes en el suero podrían ser mínimas ya que gran parte de los métodos de administración de CRISPR están diseñados para liberar los componentes del sistema directamente al interior de las células a modificar.
La mayor preocupación surge cuando se considera la respuesta inmunitaria mediada por los linfocitos T, ya que las células inmunitarias que reconocen Cas9 podrían atacar las células modificadas y tener una mayor facilidad para interferir con la eficacia de CRISPR o inducir respuestas inmunitarias no deseadas en los pacientes.
En este contexto, una de las conclusiones más importantes del trabajo es que la respuesta del sistema inmunitario frente a los componentes de CRISPR es un tema que necesita ser estudiado con mayor profundidad ya que, en definitiva, todavía se desconoce cómo sería la posible respuesta inmunitaria al tratamiento con CRISPR en caso de producirse o si podría comprometer la eficacia de CRISPR.
El equipo de Porteus trabaja en el desarrollo de un tratamiento para la anemia falciforme basado en la modificación del genoma mediante CRISPR. En su caso, la edición del genoma y la exposición a Cas9 se lleva a cabo en células progenitoras de la sangre que han sido extraídas de los pacientes. Tras la edición con CRISPR las células modificadas se amplifican hasta alcanzar un número adecuado y son introducidas de nuevo en el paciente. En estas circunstancias de tratamiento ex vivo es poco probable que la utilización de CRISPR genere una respuesta inmunitaria en el paciente, ya que los componentes del sistema son utilizados fuera del organismo y son las células modificadas, libres de ellos, las que se reintroducen en el paciente. Sin embargo, si se consideran terapias in vivo, en las que se administran los componentes de CRISPR al organismo, bien de forma sistémica o en zonas concretas, la respuesta del sistema inmunitario podría tener un papel crucial, hecho que preocupa especialmente a Porteus.
Los autores del trabajo proponen algunas soluciones para evitar la respuesta del sistema inmunitario humano frente a SaCas9 o SpCas9, como por ejemplo utilizar nucleasas diferentes a Cas9, a las que no haya podido estar expuesto el sistema inmunitario humano o utilizar nucleasas de diseño que no activen la respuesta inmunitaria. En cualquier caso recomiendan profundizar en el estudio de la inmunogenicidad de los componentes de CRISPR.
Tal y como concluyen los investigadores, su estudio plantea nuevas consideraciones sobre la aplicación del sistema Cas9 en la edición de las células humanas con objetivos terapéuticos. Los resultados de Porteus demuestran la importancia de entender la respuesta inmunitaria en el contexto de los tratamientos con CRISPR, aspecto que Porteus consideraba que no recibía suficiente atención en medio de todo el entusiasmo por la herramienta de edición genómica. El trabajo también fomenta el diálogo entre la comunidad científica para encontrar la forma más segura y efectiva de utilizar CRISPR en humanos. Esta es una de las razones por la que los investigadores decidieron publicar el artículo en bioRxiv, plataforma que permite la publicación de artículos antes estos sean sometidos a una revisión por parte de expertos.
“Como en toda nueva tecnología, se quiere identificar los problemas potenciales y diseñar soluciones para ellos,” ha declarado Porteus para STAT News. El investigador, que además de ser profesor en la Universidad de Stanford es fundador de CRISPR Therapeutics, empresa biotecnológica enfocada en el desarrollo de terapias basadas en CRISPR, cree que ese es el punto en el que se encuentra la comunidad científica y añade que la inmunidad del organismo frente a CRISPR es un aspecto que debería tenerse en cuenta.
La respuesta al trabajo no se ha hecho esperar. Pocos días tras la publicación del trabajo varias empresas del sector han visto cómo decrecía el valor de sus acciones y cuestionan los resultados del estudio.
Referencia: Charlesworth CT, et al. Identification of Pre-Existing Adaptive Immunity to Cas9 Proteins in Humans. bioRxiv. 2018. Doi: https://doi.org/10.1101/243345.
Fuentes: CRISPR hits a snag: Our immune systems may attack the treatment. https://www.statnews.com/2018/01/08/immunity-crispr-cas9/
