Cerca de 200 especialistas en Hemato-Oncología, representantes políticos y de la industria farmacéutica abordan la evolución de las terapias avanzadas contra el cáncer y los retos de su regulación en el acceso de los pacientes, en el Curso de Imunoterapia y Terapia Celular en Hemato-Oncología que la Clínica Universidad de Navarra está celebrando los días 5 y 6 de junio en Madrid.
¿Qué son las terapias avanzadas?
Como define la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), los tratamientos de terapia avanzada son medicamentos de uso humano basados en genes (terapia génica), células (terapia celular) y/o tejidos (bioingeniería o ingeniería tisular). El origen de las células, genes o tejidos, puede ser autólogo (donante y receptor son el mismo), alogénico (el donante y receptor son diferentes personas) o xenogénico (el donante es de diferente especie a la del receptor).
Estas terapias constituyen nuevas estrategias terapéuticas con prometedores resultados en algunas enfermedades no resueltas. Su desarrollo supone ampliar las oportunidades de tratamiento para algunas patologías que hasta el momento carecen de alternativas eficaces.
Dada su novedad, los mecanismos de acción y la complejidad de su desarrollo, tanto a nivel industrial –desde las compañías farmacéuticas- como académico –realización desde los hospitales-, es necesaria una regulación adecuada para conseguir aplicar criterios coherentes en su desarrollo clínico, así como su sostenibilidad y equidad en el Sistema Nacional de Salud que permitan la aplicación de estas terapias innovadoras y de alto coste económico.
¿Cuál es el papel de las terapias avanzadas en el tratamiento contra el cáncer?
En la lucha contra el cáncer la inmunoterapia ha supuesto una gran revolución al conseguir reactivar y estimular el sistema de defensas del propio paciente en la lucha contra su tumor.
Dentro del campo de la inmunoterapia emerge con fuerza la terapia celular adoptiva, un tipo de terapia avanzada que consiste en la extracción y uso de las células del sistema inmune propias de un paciente para tratar su cáncer. La terapia celular adoptiva incluye dos tipos de tratamientos: el que emplea células T (células CAR-T) y el basado en el uso de linfocitos infiltrantes tumorales (LIT).
¿Qué papel juegan las células T?
Las células T, o linfocitos T, son un tipo de células de la sangre responsables de detectar una posible amenaza y activar la respuesta inmunitaria del organismo para eliminarla. En ocasiones, el cáncer consigue “camuflarse” y escapar de estos mecanismos de defensa. En un intento de dotar a los linfocitos T del paciente de “herramientas” que reconozcan las células tumorales y de “armas” que ayuden a destruirlo, surge la terapia con células CAR-T.
La terapia CAR-T o la generación de “súper polis”
El tratamiento con células CAR-T es una nueva estrategia de inmunoterapia que combina dos formas de terapia avanzada: la terapia celular y la terapia génica. Consiste en extraer del paciente con cáncer células T (autólogas si son del propio paciente, o alogénicas si son de un donante) y, en el laboratorio, introducirles un material genético que las capacita para reconocer de nuevo al tumor y para activar su maquinaria de destrucción. Así, la nueva célula T modificada goza de unos “identificadores” específicos de detección y destrucción de las células cancerígenas llamados receptor de antígeno quimérico (en inglés, Chimeric Antigen Receptors), de ahí el nombre de esta terapia. Una vez reprogramadas genéticamente, las células T “fortalecidas” se trasfunden de nuevo al paciente para que “maten” las células malignas sin dañar las sanas. En otras palabras, cuando un cáncer “esquiva” al sistema inmunitario es porque nuestros “soldados” están “ciegos” (no ven bien al tumor) y se han quedado sin “balas” (no son capaces de proliferar y matarlo). La terapia CAR-T otorga a estas células “súper visión” para detectar a ese tumor y la “artillería” necesaria para combatirlo.
¿Qué está logrando la terapia con CAR-T?
Los resultados están siendo muy prometedores. En concreto, en algunos tipos de leucemia, linfoma o mieloma (cánceres que suponen el 10% de todos los diagnosticados), el tratamiento con células CAR-T es capaz de producir respuestas completas de la enfermedad en pacientes sin otras opciones terapéuticas.
Estos resultados han llevado a la aprobación de los dos primeros medicamentos CAR-T por las agencias reguladores americana (FDA) y europea (EMA) en un tiempo récord. En la actualidad existen 432 ensayos clínicos activos cuyo objetivo es confirmar estos resultados y expandirlos a tumores cerebrales, renales o colorrectales, entre otros. La industria farmacéutica en general reacia a las terapias celulares, se ha volcado en desarrollar medicamentos de células CAR-T. Además, grupos de investigación académicos también han puesto en marcha ensayos clínicos con esta terapia. En este sentido en la Clínica Universidad de Navarra, además de participar en ensayos de la industria (tanto en mieloma como linfomas), está desarrollando investigación y futuros ensayos clínicos académicos en colaboración tanto con hospitales españoles como centros europeos, en este caso financiados con fondos de la Unión Europea (Programa Horizonte 2020).
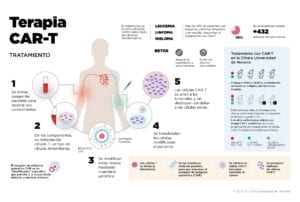
Tratamiento con CAR-T en la Clínica Universidad de Navarra
La Clínica Universidad de Navarra tiene abiertos 4 ensayos clínicos de terapia avanzada con células CAR-T dirigidos al tratamiento del mieloma múltiple y del linfoma no Hodgkin, ambos dirigidos a pacientes en recaída y resistentes al tratamiento convencional. Además, tiene previsto activar antes de finales de año otras cuatro investigaciones clínicas contra estos mismos tumores hematológicos, además de contra la leucemia linfoblástica aguda (LLA). Estos cánceres de la sangre son los más frecuentes y suponen el 10% de todos los tumores diagnosticados en España.
Entre los estudios que la Clínica prevé iniciar pronto, figuran dos ensayos clínicos con terapia CAR-T académica, es decir, ensayos en los que la fabricación del medicamento de células CAR-T la realiza un hospital universitario. La Clínica participa, junto con otros hospitales españoles, en estas investigaciones impulsadas por el Hospital Clínic de Barcelona, destinadas a tratar el mieloma múltiple y la LLA. A su vez, la Clínica también va a activar en marzo de 2020 otro estudio contra el mieloma múltiple con terapia CAR-T académica. Se trata de un ensayo internacional liderado por el Hospital Universitario de Wurzburgo (Alemania), donde la Clínica es el único centro español de entre los cinco centros europeos participantes.
Beneficios y retos de la investigación para el desarrollo de terapia CAR-T
La leucemia linfoblástica aguda es el tumor más frecuente en niños. En general, es una enfermedad que, en población pediátrica, tiene muy buenos resultados con unas tasas de remisión completa de entorno al 90% y tasas de curación en torno al 70-80%. Sin embargo, los resultados en aquellos pacientes que no responden o recaen, son mucho peores con supervivencias a largo plazo no superiores al 20%. Son estos pacientes (el 10%) los que se benefician del tratamiento con CAR-T.
Aprobación en Europa de un CAR-T contra la leucemia linfoblástica aguda:
El estudio Eliana dio la aprobación en Europa de un CAR-T frente al antígeno CD19 (Tisagenlecleucel) en pacientes pediátricos y adultos jóvenes hasta 25 años de edad con leucemia linfoblástica aguda de células B refractaria (en recaída post-trasplante o en segunda o posterior recaída) con respuestas globales en torno al 80% de los pacientes y una probabilidad de supervivencia del 66% a los 2 años, según la actualización más reciente de este ensayo clínico presentado en el último congreso de la Sociedad Americana de Hematología (ASH).
Tratamiento del linfoma no Hodgkin:
Por otro lado, el linfoma no Hodgkin difuso de célula grande B es el tipo de linfoma más común en adultos con una incidencia anual de 7-8 casos por cada 100.000 personas/año. El tratamiento de elección para estos pacientes es la inmunoquimioterapia (habitualmente Rituximab+CHOP) con buenos resultados: supervivencia libre de progresión a 3 años del 75% y supervivencia global a 3 años del 80% aproximadamente. Sin embargo, los pacientes en recaída o refractarios tienen un pronóstico peor, con tasas de respuesta completa del 8% y una mediana de supervivencia que no llega a los 5 meses en pacientes más allá de la segunda línea de tratamiento.
En la actualidad, existen dos productos comerciales basados en la utilización de células CAR-T aprobados para este tipo de pacientes. El ensayo clínico ZUMA-1 dio la aprobación de Axicabtagene ciloleucel un CAR-T frente a CD19, en adultos con linfoma difuso de células grandes B o linfomas primarios de mediastino de célula grande B tras dos o más líneas de tratamiento. La última actualización de este ensayo publicada este año en Lancet Oncology mostró respuestas globales del 74% (respuestas completas del 54%) y una mediana de supervivencia hasta la fecha no alcanzada de 24 meses en el 51% de los pacientes. Por otro lado, el ensayo clínico JULIET ha llevado a la aprobación de Tisagenlecleucel para el tratamiento de linfoma no Hodgkin de células grandes B después de dos líneas de tratamiento. Los resultados de este trabajo publicados este año en New England Journal of Medicine mostraron unas respuestas globales del 52% (40% de respuestas completas) con una media de supervivencia de 11 meses.
La terapia con CAR-T está irrumpiendo con fuerza además en otras neoplasias hematológicas. El uso de CAR-T frente al receptor de antígeno de maduración de célula B (BCMA) en el contexto del mieloma múltiple ha mostrado resultados muy prometedores para estos pacientes, aunque por el momento no hay ningún producto aprobado para su aplicación clínica. Por último, para otras neoplasias hematológicas como el linfoma de Hodgkin o la leucemia mieloblástica aguda y algunas neoplasias sólidas también se están iniciando ensayos clínicos con células CAR-T, aunque a día de hoy, los resultados clínicos son muy escasos.
Efectos secundarios
A pesar de su enorme eficacia, el tratamiento con células CAR-T también se asocia con posibles efectos secundarios que en algunas ocasiones debido a su severidad pueden incluso llevar a la muerte de los pacientes.
Uno de los más frecuentes es el síndrome de liberación de citosinas, que aparece en la mayoría de pacientes. La terapia CAR-T es un tratamiento vivo y en su mecanismo de acción se incluye que al detectar el antígeno frente al que van dirigidos (CD19, BCMA…) estas células CAR-T se activan y expanden de manera exponencial para atacar el tumor. La expansión produce la liberación de múltiples citocinas al torrente sanguíneo que son la causa de este efecto adverso. La forma de presentación del síndrome de liberación de citocinas es muy variada y puede ir desde una fiebre alta hasta un fallo multiorgánico. Sin embargo, a día de hoy, tenemos fármacos para controlar este efecto secundario y en la mayoría de pacientes desaparece a los 3-4 días sin generar grandes problemas.
Otro efecto secundario importante asociado a estos fármacos es la toxicidad neurológica. La presentación de la toxicidad neurológica es muy variada y puede ir desde una simple cefalea hasta el edema cerebral. En la mayoría de pacientes, la neurotoxicidad va asociada al síndrome de liberación de citocinas y el tratamiento de esté lleva a la resolución de la toxicidad neurológica.
A pesar de estos avances, estamos únicamente al principio del camino. Numerosos grupos de investigación están centrando su investigación en mejorar las terapias CAR-T con distintas estrategias: CAR dirigidos contra antígenos más específicos de la célula tumoral y por tanto capaces de actuar contra otros tipos de tumores; mejorar la eficacia de los CAR identificando los tipos de linfocitos T más eficaces o como prevenir el agotamiento y la eliminación de los CAR del paciente; la generación de CAR a partir de un donante que puedan servir para tratar muchos pacientes, disminuyendo el coste de la producción del medicamento son algunas de las ideas que se están desarrollando.

