La enfermedad de Alzheimer es la causa de demencia más común en el mundo y una de las enfermedades degenerativas que mayor impacto social, económico y personal tiene en nuestra sociedad. A pesar de que hace más de 100 años que Alois Alzheimer describió la enfermedad por primera vez y del gran esfuerzo que la comunidad científica ha realizado en su estudio desde entonces, aún no se conocen las causas exactas que producen el Alzhéimer esporádico. El desconocimiento de la causa primaria que lo provoca complica el diseño de una terapia génica efectiva capaz de prevenir, revertir o curar la enfermedad.
Recientemente, la empresa biotecnológica Tetraneuron, en colaboración con el Grupo de Investigación del Dr. José María Frade, del Instituto Cajal (CSIC), ha publicado unos prometedores resultados de terapia génica usando un ratón modelo de Alzhéimer en la prestigiosa revista Neurotherapeutics.
Una de las características novedosas de la posible terapia que presenta este trabajo es la diana a la que va dirigida. Alejándose de las dianas tradicionales frente a las que se han diseñado múltiples terapias en el pasado, como el péptido beta amiloide o la proteína TAU, los autores presentan al factor de transcripción E2F4 como una proteína capaz de modular numerosos aspectos y rutas implicadas en la enfermedad de Alzheimer. Tradicionalmente, este factor de transcripción se ha asociado a la regulación del ciclo celular y la quiescencia en diversos tipos celulares y tumorales mediante la regulación de la expresión de distintos genes diana. Pero, recientemente, se están descubriendo nuevas funciones muy diferentes de E2F4, incluyendo la respuesta al estrés celular, daño al ADN y otros procesos relacionados con la enfermedad de Alzheimer. En condiciones de estrés, p38Map Quinasa fosforila E2F4 inhibiendo su función, lo que desencadena la aparición de los diferentes daños neuronales presentes en la enfermedad de Alzheimer. Los autores del trabajo han realizado una modificación de esta proteína, a la que denominan E2F4DN, eliminando de su secuencia dos aminoácidos de treonina que serían susceptibles de fosforilación y que, a diferencia de la forma nativa, no sería fosforilable en dichas posiciones.
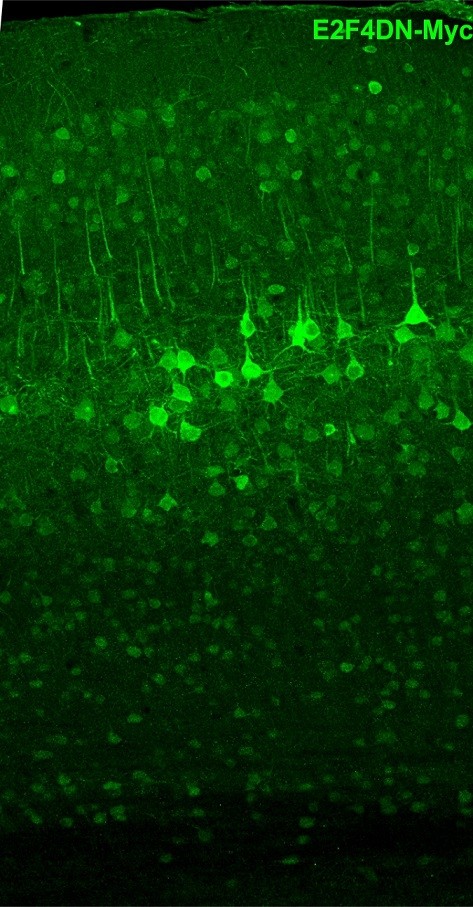
La segunda característica innovadora de la terapia que propone el trabajo es que se trata de una terapia génica. Los autores utilizan como vector una versión optimizada de adenovirus para expresar la proteína E2F4DN (AAV-E2F4) en neuronas de ratón adulto, administrada como una única dosis por vía intravenosa. La afinidad del serotipo de adenovirus utilizado, así como la expresión de E2F4DN bajo el control del promotor específico neuronal de la sinapsina (hSyn) hace que la expresión de la proteína en las neuronas cerebrales sea muy eficiente (Figura 1) incluso un año después de la inyección, y que exista muy poca expresión en hígado y que incluso sea indetectable en otros órganos como pulmón, ovario, bazo, corazón o riñón.
Expresando esta proteína en las neuronas cerebrales de un modelo murino de Alzhéimer, los autores han podido evaluar el impacto que esta proteína tiene en distintos aspectos y síntomas de la enfermedad. En este contexto de enfermedad de Alzheimer, la expresión neuronal de E2F4DN también posee efectos beneficiosos sistémicos, como la recuperación de la pérdida de peso que estos ratones presentan a largo plazo y el aumento de su esperanza de vida en un 20% frente a los ratones no tratados.
Las placas de proteína beta Amiloide en el cerebro, uno de los signos más característicos de la enfermedad de Alzheimer, así como los niveles solubles de dicha proteína, se reducen significativamente en los animales inyectados con AAV-E2F4DN.
A nivel cerebral, existen indicios de que una respuesta inflamatoria exacerbada, mediada por astrocitos reactivos y microglía en el cerebro de los pacientes de Alzhéimer, es una de las posibles causas directas del daño neuronal en el transcurso de la enfermedad. La terapia génica con E2F4DN reduce también significativamente los niveles de astrogliosis y microgliosis en los animales tratados, como se refleja en la reducción del área ocupada por dichas células utilizando marcadores específicos como GFAP e Iba1. La tetraploidía neuronal, fenotipo que los autores han asociado anteriormente con la enfermedad de Alzheimer, también presenta una reducción significativa y proporcional a los niveles de expresión de E2F4DN en los animales tratados.
En el aspecto comportamental, la terapia también fue capaz de producir una mejora significativa sobre la pérdida de memoria que presenta el grupo de los no inyectados. Los resultados obtenidos por los animales inyectados en dos test cognitivos (Y-maze y Morris Water Maze) demuestran que la terapia es capaz de reducir la pérdida cognitiva en modelos de Alzhéimer.
La capacidad que ha demostrado esta terapia para modular procesos tan diversos asociados a la enfermedad de Alzheimer hacen de esta molécula un prometedor agente terapéutico para su administración en humanos. En la actualidad, Tetraneuron está iniciando los estudios de preclínica regulatoria necesarios para entrar en fases clínicas en un futuro próximo.
Referencia: López-Sánchez N, Garrido-García A Ramón-Landreau M, Cano-Daganzo V y Frade JM E2F4-based gene therapy mitigates the phenotype of the Alzheimer’s disease mouse model 5xFAD. Neurotherapeutics. 2021 DOI: http://dx.doi.org/10.1007/s13311-021-01151-1
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos y formación universitaria.


