Angel Díaz-Lagares1,2 & Ana B. Crujeiras1,3,4
1Programa de Epigenética y Biología del Cáncer (PEBC), Instituto de Investigación Biomédica de Bellvitge (IDIBELL), Barcelona, Cataluña, España.
2Actualmente: Laboratorio de Epigenómica del Cáncer, Oncología Médica Traslacional (Oncomet), Instituto de Investigación Sanitaria de Santiago (IDIS), Santiago de Compostela, Galicia, España.
3Actualmente: Laboratorio de Endocrinología Molecular, Instituto de Investigación Sanitaria de Santiago (IDIS), Complejo Hospitalario Universitario de Santiago, Santiago de Compostela, España.
4 Centro de Investigación Biomédica en Red (CIBER), Fisiopatología de la Obesidad y Nutrición (CIBERobn), Instituto Salud Carlos III, Santiago de Compostela, España.

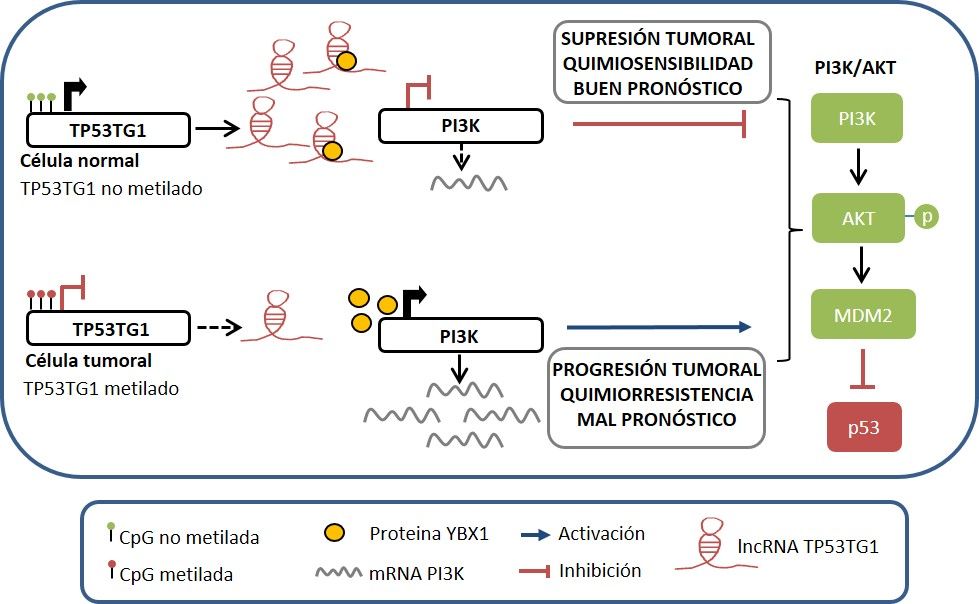
En este trabajo hemos identificado uno de los mecanismos responsables de la resistencia múltiple al tratamiento quimioterápico del cáncer. Este descubrimiento, que ha sido publicado recientemente en la revista Proceedings of the National Academy of Science (PNAS), describe cómo la alteración epigenética de un ARN no codificante largo, denominado TP53TG1 (TP53 target 1), se asocia con la ausencia de respuesta al tratamiento anti-tumoral en tumores gastrointestinales. En este estudio, que ha sido dirigido por Manel Esteller, hemos evidenciado que la inactivación de TP53TG1 mediante mecanismos epigenéticos (hipermetilación) favorece la resistencia de los tumores a la quimioterapia, evita la respuesta efectiva de p53 al daño del ADN e induce la progresión de los tumores.
En los últimos años los ARNs no codificantes largos (long non-coding RNAs o lncRNAs) han empezado a ser reconocidos como importantes moléculas con un papel clave en la regulación del correcto funcionamiento de las células. Este tipo de ARNs no codificantes se caracterizan por presentar un tamaño superior a 200 nucleótidos, carecer de capacidad para dar lugar a proteínas y controlar la función de múltiples genes. Uno de los mecanismos capaces de regular la expresión de este tipo de moléculas son las modificaciones epigenéticas, como la metilación del ADN, que suele producirse en la región promotora de los genes. Las alteraciones en el patrón de expresión de los lncRNAs se asocian con el desarrollo y progresión de enfermedades como el cáncer. Esta enfermedad representa hoy en día uno de los mayores retos de nuestra sociedad debido a las importantes repercusiones que tiene para la salud y al elevado número de pacientes afectados. Afortunadamente, la quimioterapia empleada para tratar esta enfermedad supuso una gran revolución, ya que estos fármacos han demostrado ser efectivos en un amplio abanico de pacientes oncológicos. Sin embargo, este tipo de terapia no resulta efectiva en algunos pacientes, cuyos tumores pueden presentar una ausencia de respuesta o resistencia cruzada contra distintos fármacos con estructuras químicas diversas y no relacionadas.

Desde un punto de vista molecular, existe una estrecha relación entre los lncRNAs y la acción de las proteínas. Así, no solo hay proteínas, como los factores de transcripción, que pueden modificar su expresión, sino que los lncRNAs pueden ejercer algunas de sus funciones mediante la interacción con proteínas claves para el funcionamiento de la célula normal y tumoral. Este es el caso de TP53TG1, cuya expresión se incrementa tras un daño en el DNA por el efecto del factor de transcripción p53, desencadenando así un proceso de apoptosis o muerte celular programada en la célula. Por otro lado, el lncRNA TP53TG1 es capaz de interaccionar con la proteína oncogénica YBX1 regulando su localización en la célula. De este modo, en las células no tumorales TP53TG1 retiene a YBX1 en el citoplasma evitando que esta proteína vaya al núcleo para favorecer la progresión tumoral. Por el contrario, en la célula tumoral la inactivación epigenética de TP53TG1 permite que YBX1 vaya al núcleo de la célula y active múltiples oncogenes que favorecen la resistencia de las células malignas a la acción de los fármacos quimioterápicos.
Beneficios clínicos para los pacientes y la oncología de precisión
La detección de la hipermetilación de TP53TG1 en los tumores podría tener importantes beneficios clínicos para los pacientes oncológicos. En este estudio se identificó que alrededor de un 10% de los tumores gastrointestinales presentan inactivación de TP53TG1 debido a un proceso epigenético de hipermetilación. Este porcentaje de tumores hipermetilados resultó especialmente significativo en pacientes con cáncer gástrico. Debido a que esta alteración epigenética se asoció a mecanismos de resistencia al tratamiento quimioterápico, el análisis de la metilación de TP53TG1 en los tumores antes de iniciar la quimioterapia podría favorecer la identificación de los pacientes que se van a beneficiar de este tratamiento y contribuir así a la práctica de una oncología de precisión. La inactivación de TP53TG1 en los tumores no solo favorece la resistencia a los fármacos usados habitualmente en la práctica clínica (doxorrubicina, irinotecan, carboplatino, cisplatino y oxaliplatino) sino que también lo hace con un tipo de fármacos de nueva generación, los inhibidores de quinasas, que están dirigidos a inactivar dianas moleculares concretas, como AKT y PI3K, las cuales favorecen la progresión tumoral. También, pudo comprobarse que los pacientes con tumores gastrointestinales que presentan inactivación de TP53TG1 se caracterizan por un peor pronóstico de su enfermedad, de modo que su enfermedad progresará con mayor rapidez. En este sentido, el análisis epigenético de TP53TG1 en tumores gastrointestinales, especialmente cáncer gástrico, mostró utilidad como biomarcador capaz de predecir cómo va a evolucionar la enfermedad antes de recibir el tratamiento quimioterápico.
En conclusión, nuestro estudio proporciona un ejemplo de un lncRNA supresor de tumores regulado por p53 cuya inactivación epigenética en tumores colorectales y gástricos podría tener repercusiones en la efectividad de un amplio número de tratamientos quimioterápicos que reciben estos pacientes oncológicos. La existencia de este mecanismo múltiple de resistencia contribuye a explicar que los pacientes con inactivación de TP53TG1 presenten una menor supervivencia. De este modo, la detección de la hipermetilación de TP53TG1 podría llegar a ser un biomarcador con utilidad clínica para evaluar la respuesta terapéutica en la oncología de precisión.
Investigación original: Diaz-Lagares A, et al. Epigenetic inactivation of the p53-induced long noncoding RNA TP53 target 1 in human cancer. Proc Natl Acad Sci U S A. 2016. Nov 7. Doi: 10.1073/pnas.1608585113
