Álvaro Plaza Reyes y Sandra Petrus-Reurer
Karolinska Institutet
Investigadores del Instituto Karolinska en Suecia han descubierto la forma de refinar la producción de células de la retina a partir de células madre embrionarias con el fin de tratar la degeneración macular asociada a la edad mediante terapia celular. Además, haciendo uso de la técnica CRISPR/Cas9, los mismos investigadores también han logrado modificar dichas células para que puedan esconderse del sistema inmune, evitando así su posible rechazo tras ser trasplantadas en pacientes. Los estudios se publican en las revistas científicas Nature Communications y Stem Cell Reports.
La degeneración macular asociada a la edad (DMAE) es la causa más común de ceguera en personas mayores de 50 años en los países occidentales. Esta enfermedad, que provoca la pérdida de visión en el centro del campo visual, es causada por la muerte de los fotorreceptores en la zona de la retina responsable de la visión de alta resolución, también conocida como mácula. Se sabe que la muerte de los fotorreceptores es debida a la degeneración y posterior muerte del epitelio pigmentario de la retina (conocido por las siglas EPR), que realiza funciones esenciales para asegurar la homeostasis de los fotorreceptores y otras células adyacentes.
Dependiendo de la naturaleza del daño retiniano, la DMAE se divide en dos subtipos: DMAE húmeda, o exudativa, y DMAE seca, o atrófica. La DMAE húmeda se caracteriza por un crecimiento anormal de los vasos sanguíneos desde la coroides hacia el espacio subretiniano, también conocido como neovascularización, lo cual produce edema y hemorragias que finalmente son responsables del daño del EPR y fotorreceptores y conduce a la pérdida de la visión. Por el contrario, en la DMAE seca no existe neovascularización y, en su lugar, la pérdida de fotorreceptores resulta de una atrofia y degeneración progresiva de la capa de EPR, por razones aún no del todo conocidas.
Actualmente existen tratamientos para la forma húmeda de la enfermedad, tales como los medicamentos destinados a bloquear el factor de crecimiento del endotelio vascular (VEGF), que consiguen retardar el desarrollo anormal de vasos sanguíneos en el ojo. Sin embargo, pese a ser la forma más común de la enfermedad, hasta ahora no se han reportado tratamientos eficientes para la DMAE seca, por lo que la mayoría de las estrategias de tratamiento hasta la fecha se han enfocado en trasplantar células EPR sanas con el fin de prevenir o reparar la pérdida secundaria de fotorreceptores y potencialmente mantener o restaurar la visión.
Con el objetivo de encontrar una fuente ilimitada de células EPR jóvenes y sanas para trasplante, diversos grupos han comenzado a explorar la posibilidad de generar EPR a partir de células madre pluripotentes humanas (hPSC). Actualmente se utilizan dos tipos diferentes de hPSC para la diferenciación en EPR:, las células madre embrionarias (hESC), derivadas de embriones excedentes de procesos de fertilización in vitro que fueron donados para su uso en investigación, y las células madre pluripotentes inducidas (hiPSC), que se generan a partir de células somáticas adultas mediante reprogramación química o genética. Ambos tipos de células presentan un gran potencial como punto de partida para la producción de células EPR de reemplazo, ya que están fácilmente disponibles en un suministro ilimitado y se pueden diferenciar en cualquier tejido del cuerpo, lo que permite la producción de un número también ilimitado de células EPR sanas y jóvenes para su uso en medicina regenerativa.
Identificación de marcadores celulares específicos del epitelio pigmentario de la retina y desarrollo de una metodología de diferenciación más eficiente y escalable
La diferenciación de células madre pluripotentes en EPR ha sido ampliamente descrita por muchos autores. Los protocolos de diferenciación hasta ahora desarrollados generalmente implican largos tiempos de producción y no logran generar una población homogénea de células EPR, lo cual resulta crítico para su posible aplicación clínica. Aunque la pigmentación inherente de las células EPR permite evaluar a grandes rasgos las eficiencias de diferenciación, así como el aislamiento manual de estructuras pigmentadas, dicha selección manual hace que la producción a gran escala de células EPR sea engorrosa y conlleve un riesgo potencial de tumorigenicidad, al caber la posibilidad de que algunas células no diferenciadas pasen desapercibidas en el producto final.
En un nuevo estudio, publicado en la revista Nature Communications, un grupo de investigadores del Instituto Karolinska ha conseguido identificar marcadores de superficie específicos en las células EPR (en concreto uno de selección positiva y otros dos de selección negativa) que hasta ahora no habían sido descritos. Estos marcadores de superficie celular permitirían no sólo aislar y purificar células EPR de manera automatizada, sino también analizar cuantitativamente las eficiencias de diferenciación, así como confirmar la ausencia de células no deseadas, tales como posibles células indiferenciadas. Con la ayuda de estos marcadores, los autores también han sido capaces de desarrollar una nueva metodología que permite la diferenciación de hPSC a EPR de manera más eficiente, eliminando la necesidad de seleccionar manualmente las áreas diferenciadas y permitiendo así su adaptación para la producción de estas células a gran escala para su uso en un futuro ensayo clínico en pacientes, el cual prevén que pueda iniciarse en los próximos dos años.
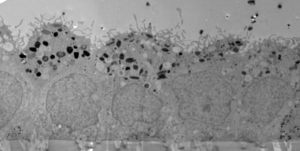
Células del epitelio pigmentario de la retina que evitan el sistema inmunitario
Un obstáculo al trasplantar tejido generado a partir de células madre es el riesgo de rechazo, que ocurre en gran medida si los antígenos de histocompatibilidad (HLA) del trasplante y del paciente difieren. Por esa razón, grupos de investigación de todo el mundo están trabajando para crear lo que se conoce como células madre universales, que idealmente no desencadenarán una respuesta inmune en ningún paciente después de su trasplante.
En un segundo estudio publicado en Stem Cell Reports, el mismo grupo del Instituto Karolinska, describió la creación de células madre embrionarias capaces de esconderse del sistema inmune. Utilizando la técnica de edición genética CRISPR/Cas9, consiguieron eliminar de la superficie de células madre embrionarias los antígenos HLA de clase I y clase II, los cuales permitirían su identificación como células exógenas por el sistema inmune del paciente llevando a su posterior eliminación y, por tanto, al fracaso del trasplante. Los investigadores comprobaron que las células madre que carecían de estas moléculas conservaban aún su capacidad para diferenciarse en células EPR y no presentaban posibles mutaciones no deseadas como consecuencia del proceso de edición genética.
A su vez, el estudio demostró que estas células EPR modificadas genéticamente eran capaces de evitar la activación y proliferación de linfocitos T y de no alterar la actividad citotóxica de las células NK. Tras trasplantar dichas células en un modelo animal xenogénico y de relevancia clínica, se observó que la respuesta inmune de rechazo también fue significativamente menor a corto plazo y la detección de anticuerpos específicos de células humanas fue más tardía comparándola con la de las células EPR no modificadas, cuyas superficies aún poseen antígenos HLA. Todo ello representa un resultado muy esperanzador para el tratamiento en humanos, ya que entonces se tratará de un trasplante autólogo o alogénico con lo que se espera un todavía menor grado de rechazo que el descrito en este estudio.
Pese a que la investigación aún se encuentra en una etapa prematura, los resultados publicados suponen un importante paso hacia la creación de células EPR universales para futuros tratamientos de la degeneración macular asociada a la edad.
Referencias:
Plaza Reyes A, et al. Identification of cell surface markers and establishment of monolayer differentiation to retinal pigment epithelial cells. Nat Commun. 2020 Mar 30;11(1):1609. doi: http://dx.doi.org/10.1038/s41467-020-15326-5
Petrus-Reurer S, et al. Generation of Retinal Pigment Epithelial Cells Derived from Human Embryonic Stem Cells Lacking Human Leukocyte Antigen Class I and II. Stem Cell Reports. 2020 Mar 5. doi: http://dx.doi.org/10.1016/j.stemcr.2020.02.006
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos y formación universitaria.



