A día de hoy, el cáncer es ya la primera o segunda causa de muerte, con una estimación global de 18,1 millones de nuevos casos y 9,6 millones de muertes anuales en 91 países analizados (Bray et al., 2018). Tanto la incidencia como la mortalidad de esta enfermedad están aumentando debido a distintos factores como el envejecimiento de la población o el aumento de factores de riesgo como son el tabaquismo, el alcohol, la contaminación y la obesidad. El cáncer es fundamentalmente una enfermedad genética y surge a partir de mutaciones en oncogenes y genes supresores de tumores. Esto supone que cada tumor tiene una combinación especifica de mutaciones que le proporcionan unas características únicas. Uno de los oncogenes más comúnmente mutados es RAS, ya que se encuentra activado en aproximadamente un tercio de todos los tumores, siendo especialmente relevante en tumores de páncreas o de colon (Karnoub & Weinberg, 2008).
En la era de la genómica y la medicina personalizada, cada día resulta más importante explotar las debilidades de cada tumor para generar terapias específicas y eficientes. Para ello, hemos usado la mosca del vinagre, Drosophila melanogaster, como modelo para generar tumores dependientes del oncogén RAS. Drosophila es un organismo simple que se ha usado, de forma exitosa, durante más de 100 años para estudios genéticos y biomédicos. Así lo demuestran los 6 premios Nobel en Medicina que se han concedido a estudios realizados en este organismo modelo. En los últimos veinte años, se ha demostrado que los modelos tumorales en Drosophila recapitulan muchas de las características de los tumores humanos, como son la evasión de la muerte celular, el exceso de proliferación, la capacidad invasiva y metastásica, la reprogramación metabólica y la presencia de inestabilidad genómica (Gonzalez, 2013; Rudrapatna, Cagan, & Das, 2012).
La mayoría de tumores sólidos humanos presentan signos de inestabilidad genómica y, sin embargo, el origen de esta inestabilidad no está claro. Se ha propuesto que la activación de oncogenes puede generar inestabilidad genómica mediante la inducción de estrés replicativo (Halazonetis, Gorgoulis, & Bartek, 2008). En nuestro artículo publicado recientemente (Murcia et al., 2019), hemos demostrado que la expresión de una forma constitutivamente activa del oncogén RAS en células epiteliales de Drosophila promueve una aceleración de la transición entre las fases G1 y S del ciclo celular. Hemos observado como esto lleva a una inducción de estrés replicativo, muy probablemente consecuencia de la disrupción de los mecanismos de regulación de la replicación. El daño en el ADN resultante de este estrés replicativo activa a p53, el gen supresor de tumores por excelencia que dirige la respuesta al daño en el ADN, promueve la reparación del daño y provoca la muerte o senescencia de las células afectadas que no puedan ser reparadas. Curiosamente, esta respuesta al daño en el ADN se encuentra bloqueada en tumores RAS y la capacidad de p53 de promover la muerte celular está completamente bloqueada por RAS, bloqueo mediado por los altos niveles de activación de ERK. Como consecuencia de todo esto, las células con altos niveles de daño se acumulan en el tejido.
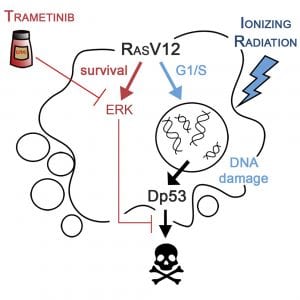
RAS es uno de los oncogenes más comúnmente mutados. Desgraciadamente, seguimos sin terapias para tratar estos tumores que sean seguras y efectivas. Con esto en mente, y basándonos en nuestros resultados anteriores, decidimos tratar de explotar el daño en el ADN presente en estas células para destruirlas de forma selectiva. A estos efectos, generamos más daño celular mediante irradiación e inhibimos la activación de ERK para así bloquear la capacidad de RAS de inhibir p53 y, por lo tanto, promover la muerte de estas células. Usamos esta estrategia tanto en tumores benignos como malignos de Drosophila y en ambos casos logramos destruir de forma selectiva las células tumorales. Estos esperanzadores resultados nos permiten proponer que los inhibidores de la vía de ERK, como el Trametinib, que se usan para el tratamiento de melanomas metastásicos, podrían combinarse con radioterapia para mejorar los efectos terapéuticos en tumores dependientes de RAS.
Referencia
Murcia, L., Clemente-Ruiz, M., Pierre-Elies, P., Royou, A., & Milán, M. (2019). Selective Killing of RAS-Malignant Tissues by Exploiting Oncogene-Induced DNA Damage. Cell Reports, 28(1), 119–131.e4. https://doi.org/10.1016/j.celrep.2019.06.004
Bibliografía
Bray, F., Ferlay, J., Soerjomataram, I., Siegel, R. L., Torre, L. A., & Jemal, A. (2018). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians, 68(6), 394–424. https://doi.org/10.3322/caac.21492
Gonzalez, C. (2013). Drosophila melanogaster: a model and a tool to investigate malignancy and identify new therapeutics. Nature Reviews. Cancer, 13(3), 172–183. https://doi.org/10.1038/nrc3461
Halazonetis, T. D., Gorgoulis, V. G., & Bartek, J. (2008). An Oncogene-Induced DNA Damage Model for Cancer Development. Science, 319(5868).
Karnoub, A. E., & Weinberg, R. A. (2008). Ras oncogenes: split personalities. Nature Reviews. Molecular Cell Biology, 9(7), 517–531. https://doi.org/10.1038/nrm2438
Rudrapatna, V. A., Cagan, R. L., & Das, T. K. (2012). Drosophila cancer models. Developmental Dynamics : An Official Publication of the American Association of Anatomists, 241(1), 107–118. https://doi.org/10.1002/dvdy.22771
