Carla Daniela Robles-Espinoza
Laboratorio Internacional de Investigación sobre el Genoma Humano, Universidad Nacional Autónoma de México, Santiago de Querétaro 76230, Mexico
Experimental Cancer Genetics, The Wellcome Trust Sanger Institute, Hinxton, Cambridgeshire, CB10 1SA, UK
Variantes genéticas comunes en el gen MC1R (receptor de melanocortina 1) están asociadas fuertemente con el fenotipo de cabello pelirrojo, las pecas y la sensibilidad al sol, todos los cuales son factores de riesgo para el desarrollo de melanoma. Las personas pelirrojas en general portan dos alelos variantes de MC1R, mientras que una gran parte de la población porta un solo alelo sin que muestren estas características físicas. En este estudio (Robles-Espinoza et al. 2016) reportamos la estimación de que en tumores de melanoma, el número esperado de mutaciones asociadas a la radiación ultravioleta es 42% mayor en personas portadoras de al menos una variante alélica de MC1R que en personas que no son portadoras, y estimamos que este número es comparable a la carga mutacional esperada asociada a 21 años adicionales de vida. También encontramos enriquecimiento de otras clases mutacionales en personas con al menos una variante alélica de MC1R, aportando evidencia de que otros procesos mutacionales no relacionados con la radiación ultravioleta están activos en estos individuos.
El receptor de melanocortina 1 (MC1R) es un receptor acoplado a proteína G expresado en la superficie de los melanocitos, el cual regula la pigmentación de la piel y controla la proliferación celular y la apoptosis (García-Borrón et al 2014). Los melanocitos generan dos tipos de melanina: La eumelanina, que es negra o café, y la feomelanina, que es anaranjada o roja. La feomelanina está asociada a piel clara, pecas, cabello pelirrojo e incapacidad para broncearse (Nasti and Timares 2015). Las personas con este fenotipo en general son fotosensibles y propensas a quemarse cuando se exponen a la radiación ultravioleta.
Diversos estudios de secuenciación en poblaciones han revelado alelos comunes de MC1R con función nula o altamente reducida que están asociados al cabello pelirrojo y fenotipo de piel clara, y a los cuales se les denomina alelos R (Valverde et al. 1995; Beaumont et al. 2008). Individuos que tienen genotipo R/R generalmente son pelirrojos, mientras que individuos con uno o cero alelos R raramente lo son. Sin embargo, algunos rasgos como el grado de bronceado después de la irradiación ultravioleta o la reflectancia de la piel dependen aditivamente del número de alelos R (Healy et al. 2000; Sturm et al. 2003). La proteína MC1R también participa en la reparación de daño a ADN, por lo que polimorfismos en ésta han sido asociados a un incremento en la apoptosis de los melanocitos y reparación ineficiente de daño a ADN (Denat et al. 2014). Colectivamente, estos factores conectan las variantes en MC1R al riesgo a desarrollar melanoma (Raimondi et al. 2008). Un estudio previo ha mostrado que la vía de producción de feomelanina genera un incremento en la oxidación de ADN y daño a lípidos (Mitra et al. 2012), lo que sugiere que la pérdida de la función de MC1R, aún en ausencia de luz ultravioleta, puede ser oncogénica. Sin embargo, a pesar de estas observaciones, todavía no se había explorado si los alelos R influyen en la carga de mutaciones somáticas en tumores de melanoma.
En un estudio publicado recientemente analizamos esta pregunta utilizando datos públicos generados por The Cancer Genome Atlas (TCGA) y por el Yale Melanoma Genome Project (Robles-Espinoza et al. 2016). Estos grandes proyectos han publicado las secuencias genéticas del ADN de las células germinales de pacientes y del de su tumor. El número total de muestras de melanoma analizadas fueron 405, de las cuales 273 fueron de TCGA y 132 de Yale.
Lo primero que hicimos fue determinar el genotipo de MC1R en las muestras de ADN de las células germinales de estos pacientes y clasificarlos por su genotipo en dos grupos: portadores de al menos un alelo R y no portadores. En los datos de TCGA, 135 individuos portaron al menos un alelo R y 138 no, mientras que en los datos de Yale 59 eran portadores de al menos un alelo R y 73 no lo eran.
Después, modelamos la relación entre el número de mutaciones en los tumores de estos individuos y su genotipo R (portadores y no portadores). Elegimos hacer esto por medio de una regresión binomial negativa, principalmente debido a la distribución dispersa de los conteos de mutaciones en los tumores. Para los datos de TCGA, pudimos controlar por varias variables que habían sido registradas al momento de recolectar los tumores: edad de diagnóstico, sexo, tipo de muestra (tumor primario o metástasis), centro de recolección del tumor, área del cuerpo de donde fue recolectado el tumor, grosor de Breslow, nivel de Clark, y estado de ulceración. Los datos no disponibles en estas variables fueron imputados. En los datos de Yale, las variables de edad de diagnosis, sexo y tipo de muestra estaban disponibles y pudimos controlar por éstas.
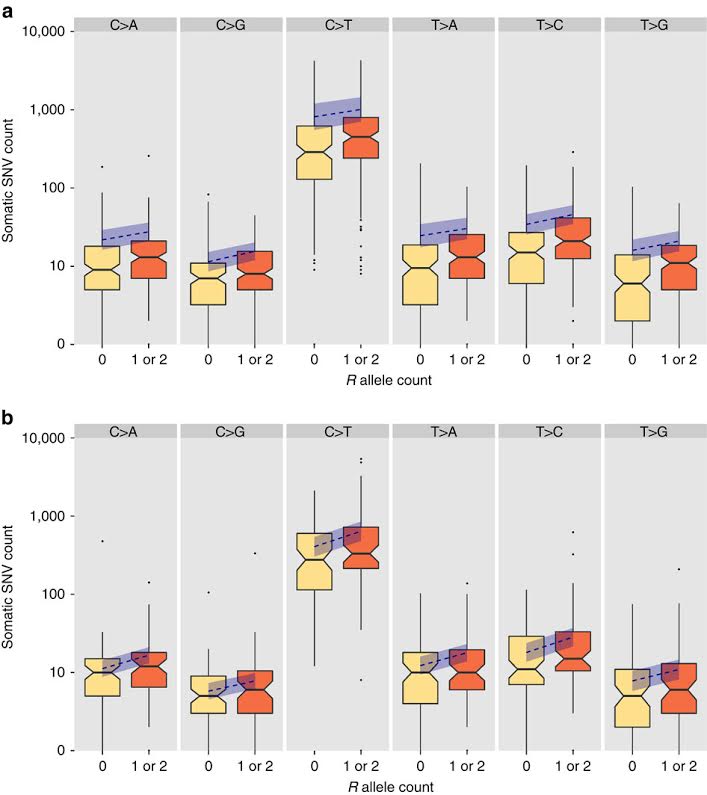
En la figura se puede apreciar la distribución del número de mutaciones por tumor clasificadas por tipo de mutación y presencia o ausencia de un alelo R; en el panel superior se ve el set de datos de TCGA y en el inferior el de Yale. En resumen, para todas las clases mutacionales, hay evidencia de un aumento del número de mutaciones en portadores de un alelo R comparados con los no portadores. Las pruebas estadísticas nos indicaron que, cuando combinamos los dos conjuntos de datos, el aumento en el número de mutaciones fue significativo en las 6 clases mutacionales. Estimamos que el número de mutaciones aumentó en un rango de 27 a 60% en las personas portadoras de un alelo R, dependiendo de la clase mutacional. Para la clase C>T, la cual está asociada a irradiación ultravioleta, este aumento fue de 42%, con un intervalo de confianza del 95% de 15 a 76%.
La edad también resultó un predictor significativo del número de mutaciones: Para la clase C>T, estimamos que cada año de vida está asociado con un aumento del 1.7% en el número de mutaciones. Esto significa que para esta clase de mutaciones, y por ende para las mutaciones asociadas a la irradiación ultravioleta, la carga de mutaciones asociados a ser portador de un alelo R es comparable a aquélla obtenida en 21 años de vida.
En este estudio también hicimos algunos experimentos para intentar determinar si el aumento que observamos en el número de mutaciones en los portadores de alelos R podría deberse a un defecto en la reparación de daño a ADN. Nuestros experimentos, llevados a cabo en cultivos de melanocitos primarios humanos, revelaron que las células que tenían MC1R defectuoso (comparable a lo que sucede en los portadores de alelos R) morían más rápido cuando eran irradiadas con luz ultravioleta, y poseían menor capacidad de reparación del daño a ADN ocasionada por esta irradiación. Esto nos indica que es posible que el mayor número de mutaciones observado en los portadores de alelos R sea debido a una capacidad reducida de sus células de reparar el daño a ADN.
En resumen, en este estudio encontramos que ser portador de al menos un alelo R es un predictor significativo para el número de mutaciones en un tumor de melanoma. Estos resultados son importantes porque son aplicables a una gran parte de la población. Por ejemplo, se estima que alrededor del 25% de la población inglesa es portadora de uno de estos alelos. Esto quiere decir que esta parte de la población podría estar en riesgo elevado de padecer melanoma, aunque no sean pelirrojos ni posean características fenotípicas típicas normalmente asociadas a este genotipo. También es importante porque encontramos que otros tipos de mutaciones, no solamente aquéllas asociadas al sol, aparecen en mayor número en portadores de alelos R que en no portadores. Esta observación, junto con nuestros experimentos en melanocitos primarios humanos, proveen evidencia de que otros mecanismos no asociados a la irradiación ultravioleta, tales como defectos en la reparación a ADN, podrían jugar un papel importante en la predisposición a melanoma en esta parte de la población.
Creemos que este trabajo tiene implicaciones para nuestro entendimiento del origen del melanoma, sobre todo en individuos portadores de estos alelos. También creemos que refuerza, y redirige a una gran parte de la población, un mensaje de salud pública ya conocido por todos: que hay que ser cuidadosos cuando salimos al sol, y que hay que aplicar bloqueador solar constantemente y cubrirnos de los rayos ultravioleta.
Referencias:
Robles-Espinoza CD, et al. Germline MC1R status influences somatic mutation burden in melanoma. Nat Commun. 2016 Jul 12;7:12064. doi: 10.1038/ncomms12064.
Bibliografía:
Beaumont KA, et al. Red hair is the null phenotype of MC1R. Hum Mutat. 2008 Aug;29(8):E88-94. doi: 10.1002/humu.20788
Denat L, et al. Melanocytes as instigators and victims of oxidative stress. J Invest Dermatol. 2014 Jun;134(6):1512-8. doi: 10.1038/jid.2014.65.
García-Borrón JC, et al. MC1R, the cAMP pathway, and the response to solar UV: extending the horizon beyond pigmentation. Pigment Cell Melanoma Res. 2014 Sep;27(5):699-720. doi: 10.1111/pcmr.12257
Healy E, et al. Melanocortin-1-receptor gene and sun sensitivity in individuals withoutred hair. Lancet. 2000 Mar 25;355(9209):1072-3. Doi: 10.1016/S0140-6736(00)02042-0
Mitra D, et al. An ultraviolet-radiation-independent pathway to melanoma carcinogenesis in the red hair/fair skin background. Nature. 2012 Nov 15;491(7424):449-53. doi: 10.1038/nature11624.
Nasti TH, Timares L. MC1R, eumelanin and pheomelanin: their role in determining the susceptibility to skin cancer. Photochem Photobiol. 2015 Jan-Feb;91(1):188-200. doi: 10.1111/php.12335.
Raimondi S, et al. MC1R variants, melanoma and red hair color phenotype: a meta-analysis. Int J Cancer. 2008 Jun 15;122(12):2753-60. doi: 10.1002/ijc.23396.
Sturm RA, et al. The role of melanocortin-1 receptor polymorphism in skin cancer risk phenotypes. Pigment Cell Res. 2003 Jun;16(3):266-72.
Valverde P, et al. Variants of the melanocyte-stimulating hormone receptor gene are associated with red hair and fair skin in humans. Nat Genet. 1995 Nov;11(3):328-30. Doi: 10.1038/ng1195-328

