Amparo Tolosa, Genética Médica News
La reacción en cadena de la polimerasa, conocida comúnmente como PCR y probablemente la técnica molecular más extendida y conocida de todo el mundo, ha cumplido este mayo 35 años.
La idea básica de la PCR es amplificar un fragmento concreto de ADN hasta obtener miles o millones de copias del mismo. Para seleccionar la región a amplificar se utilizan dos pequeños fragmentos de ADN complementarios a los extremos del ADN de interés, que se unen a ambas cadenas de la doble hélice de ADN y pueden ser utilizados como cebadores por la enzima encargada de la síntesis de ADN, la ADN polimerasa. La clave de la técnica es que una vez se obtiene la primera copia de ADN amplificado, ésta puede actuar como molde de las sucesivas copias. Así, a través de diferentes ciclos el número de copias del fragmento amplificado va aumentando de forma exponencial.
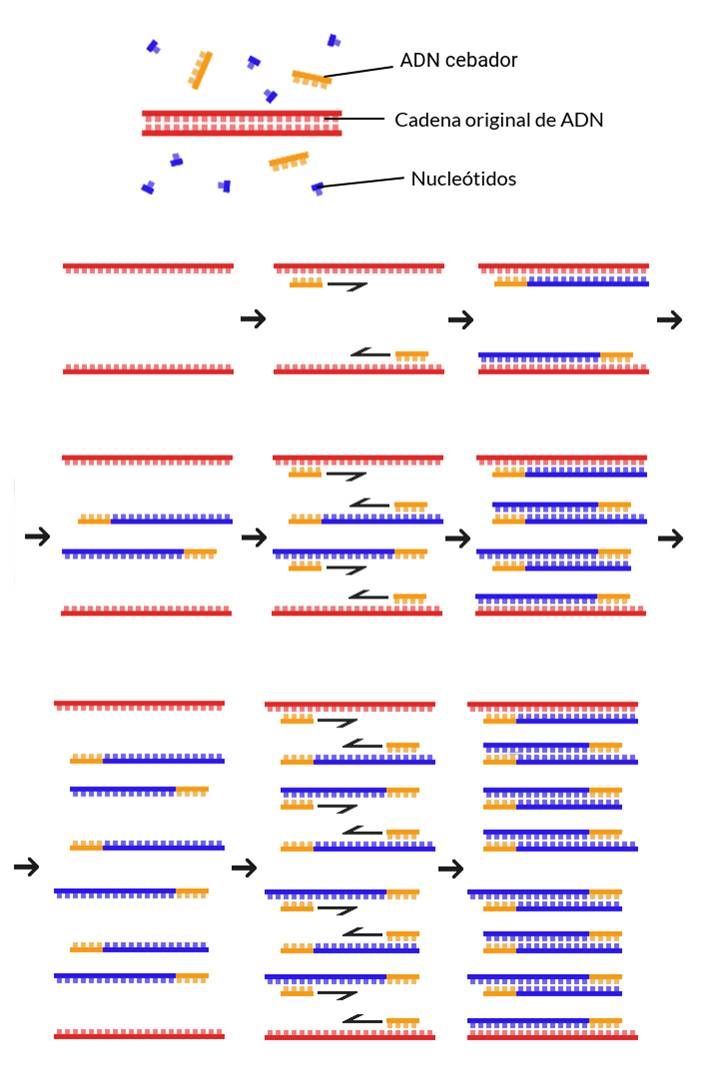
La PCR tal y como la conocemos, una amplificación cíclica dirigida por dos cebadores que se unen al ADN y delimitan la región a copiar, fue concebida en 1983 por Kary Mullis durante su etapa como químico en la empresa Cetus Corporation. Posteriormente, el equipo de investigadores de la empresa hizo una mejora crucial: utilizaron una ADN polimerasa estable a las diferentes temperaturas utilizadas en la PCR. Cada ciclo de amplificación de la PCR requiere la separación de las dos cadenas de la doble hélice de ADN, por lo que los investigadores seleccionaron la Taq polimerasa, aislada de una bacteria termófila que vive en condiciones de temperatura extrema, como polimerasa para llevar a cabo la reacción. Diez años después, Mullis recibiría el Premio Nobel de Química “por su invención del método de reacción en cadena de la polimerasa”.
En los últimos 35 años la PCR ha sido objeto de múltiples patentes y han surgido diferentes modificaciones o adaptaciones para ajustarla a las diferentes necesidades prácticas y técnicas de los investigadores. Por ejemplo, los termocicladores, instrumento fundamental para llevar a cabo las reacciones de PCR, han evolucionado desde aparatosas máquinas con capacidad para llevar a cabo un número limitado de reacciones a sofisticados aparatos con gran capacidad y precisión a la hora de controlar la temperatura. Por otra, se han desarrollado ADN polimerasas con diferentes actividades o características, destinadas, por ejemplo, a amplificar fragmentos de gran tamaño o a hacerlo con una prueba de lectura para evitar cualquier error al copiar el ADN.
La PCR se ha convertido en una herramienta fundamental tanto en investigación básica como aplicada, una pieza vital en las diferentes áreas de la biología molecular y biotecnología. Diagnóstico médico, clonación de fragmentos de ADN, terapia génica, caracterización génica, expresión génica, ciencias forenses… Casi todos los laboratorios de biología molecular equipados disponen de termocicladores de PCR. Prueba de la relevancia de la técnica de PCR es que se ha probado, con éxito, en el espacio, con el objetivo de utilizarla en futuras estaciones de investigación.
¿Hacia dónde se dirigen las últimas novedades sobre la técnica de PCR?
Por una parte, al igual que ha ocurrido en el caso de la secuenciación, uno de los caminos de desarrollo es la compactación de los sistemas de PCR. En la actualidad, los termocicladores son máquinas relativamente aparatosas, que consumen mucha energía, no se pueden mover del laboratorio y tienen un coste considerable. Su volumen, tamaño y precio llevan a que estos aparatos no estén al alcance de laboratorios con presupuesto reducido o de cualquier centro de educación o formación (como por ejemplo institutos de secundaria) y además no sea posible moverlos demasiado.

En este contexto ha surgido miniPCR, un nuevo concepto de PCR destinado a poder ser utilizado en cualquier sitio por todo aquel interesado. La miniPCR, desarrollada por los argentinos Sebastián Kraves y Ezequiel Álvarez Saavedra es un dispositivo portátil, pequeño, ligero (de tan solo 400 gramos) y barato en comparación con los habituales (menos de 1.000 dólares frente a la media de 6.000 que cuestan los grandes equipos de los laboratorios profesionales). La miniPCR, que puede operarse a través del teléfono móvil o de un ordenador, tiene como una de sus principales ventajas que puede utilizarse en cualquier localización, así como facilitar el diagnóstico de enfermedades como el Ebola, o el análisis de alimentos. Además, los investigadores responsables de este nuevo concepto de termociclador están continuamente desarrollando sistemas asociados, como geles de agarosa de fácil utilización y su rendimiento ha sido probado incluso por la NASA en el espacio.

Otra de las variaciones de la PCR es la denominada PCR digital. Esta técnica está basada en la separación de cada muestra en múltiples particiones, de forma que la reacción de amplificación tiene lugar de forma independiente en cada una de ellas. De este modo se elimina el ruido de fondo y se puede obtener medidas más sensibles y fiables de ácidos nucleicos a muy baja concentración. La información del resultado de la PCR en cada partición, positiva o negativa, es recuperada y se puede cuantificar dando proporciones totales. Aunque no es una variante de la PCR excesivamente actual (el concepto surgió en los años 90 y fue denominada como PCR digital en 1999), las mejoras que se han realizado sobre esta técnica en los últimos años apuntan a aplicaciones prácticas muy interesantes. Por ejemplo, su capacidad para detectar variantes muy poco frecuentes lleva a que sea una herramienta de gran potencial en la detección de ADN (viral, bacteriano, humano o de cualquier otro origen) en muestras biológicas o productos farmacéuticos, la monitorización de signos de rechazo de trasplantes (puede detectar ADN del donante en la sangre del paciente trasplantado) o biopsias líquidas en pacientes con cáncer.
Todo apunta a que la PCR va a seguir siendo uno de los protagonistas principales de los laboratorios de investigación básica y aplicada. Su evolución y desarrollo, sin duda va a depender de las necesidades y aplicaciones de los usuarios. Podemos estimar que mejorar su portabilidad y su rapidez son algunos de los retos a corto plazo. En cualquier caso, a sus 35 años, el potencial de la PCR no se ha agotado.
Fuentes:
Morley AA. Digital PCR: A brief history. Biomol Detect Quantif. 2014 Aug 15;1(1):1-2. eCollection 2014 Sep. Review.
MiniPCR. https://www.minipcr.com/
Genes in Space-1 (Genes in Space-1) – 03.14.18. https://www.nasa.gov/mission_pages/station/research/experiments/1913.html


