Nuevas evidencias amplían el papel del ADN extracromosómico en el cáncer y ofrecen una aproximación terapeútica.
Las células tumorales disponen de múltiples mecanismos para mantener su crecimiento y evadir los mecanismos de defensa del organismo para eliminarlas. En los últimos años el ADN extracromosómico, formado por fragmentos circulares de ADN que se encuentran fuera de los cromosomas, ha cobrado mucho interés por su papel en el desarrollo tumoral y su relación con la agresividad de algunos tumores.
El ADN extracromosómico está presente tanto en células sanas como en células pretumorales o tumorales. En las células normales se ha asociado a diferentes procesos biológicos. En las tumorales se ha observado que el ADN tumoral extracromosómico puede contener copias de oncogenes, genes que promueven la proliferación. Sin embargo, hasta el momento se desconocía el alcance de su impacto en cáncer y sus mecanismos.
Tres estudios recientes de un equipo internacional de investigadores dirigido por Paul Mischel de la Universidad de Stanford, han proporcionado nuevas evidencias sobre el papel del ADN extracromosómico en cáncer. Los resultados sugieren que el ADN extracromosómico está presente en un porcentaje mayor de cánceres de lo que se pensaba, que puede heredarse de forma coordinada entre células tumorales y que tiene un punto débil que podría ser atacado mediante fármacos específicos. Los tres trabajos se han publicado en Nature.
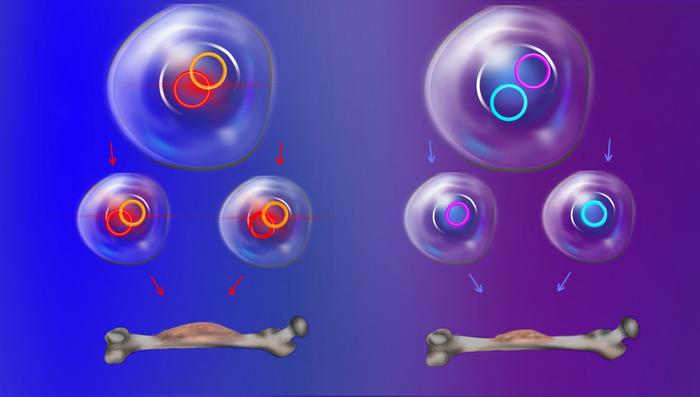
Mayor presencia de la esperada del ADN extracromosómico en tumores
En el primer estudio, basado en el análisis de 14778 pacientes de 39 tipos de cáncer, los investigadores encontraron que el ADN extracromosómico estaba presente en el 17.1% de las muestras, una frecuencia mucho mayor a la estimada anteriormente. Este ADN extracromosómico varía según el tipo de cáncer y el tejido de origen, y está especialmente presente en los cánceres más agresivos, como el glioblastoma y el liposarcoma. En estos últimos se detectó en cerca de la mitad de las muestras analizadas. Además, se detectó tanto en muestras de cáncer hereditario como en tumores relacionados con factores ambientales como el tabaco.
Al analizar la composición del ADN extracromosómico, los investigadores encontraron que puede contener desde oncogenes (genes que promueven el desarrollo de cáncer) a genes que suprimen la respuesta inmune. Además, también encontraron elementos reguladores, como secuencias potenciadoras que activan la expresión de genes.
Interesantemente, el equipo encontró que los elementos reguladores no necesitan estar en la misma molécula circular de ADN. “Esta era una idea un tanto herética”, ha destacado Howard Chang, investigador en el Instituto Howards Hughes y uno de los autores del trabajo. “Los ADNs extracromosómicos con elementos potenciadores no confieren ningún beneficio a la célula por sí solos; tienen que trabajar con otros ADNs extracromosómicos para estimular el crecimiento de las células cancerosas. Si se mira desde una óptica convencional, la presencia de ADNs extracromosómicos que codifican únicamente potenciadores no parecería un problema. Pero el trabajo en equipo y la conexión física entre los distintos tipos de ADNs circulares es en realidad muy importante en el desarrollo del cáncer”.
El ADN extracromosómico se transmite de forma irregular durante la división de las células cancerosas
Los ADNs extracromosómicos tienen un mecanismo de herencia entre células inesperado. Mientras que en las células normales los cromosomas se distribuyen de manera uniforme cuando una célula se divide, el ADN extracromosómico se hereda de forma diferente y menos predecible.
Mediante modelado computacional y análisis de células individuales, el equipo de investigadores encontró, en primer lugar, que cuando una célula se divide, las moléculas circulares de ADN extracromosómico no se distribuyen equitativamente entre las células hijas. Algunas células pueden heredar simultáneamente varias copias de ADN extracromosómico que contienen oncogenes, lo que contribuye a la heterogeneidad y resistencia en los tumores. Además, fragmentos con oncogenes y regiones reguladoras pueden distribuirse de forma coordinada en ciertas circunstancias en combinaciones ventajosas para el crecimiento tumoral y la resistencia a tratamientos.
La transmisión coordinada se debe en parte a que, en contra de lo que ocurre con el ADN de los cromosomas, la transcripción de ADN a ARN de las moléculas de ADN extracromosómico no se detiene durante la división celular. Esta situación favorece que los ADNs extracromosómicos que funcionan de forma conjunta (genes y regiones reguladoras) permanezcan conectados durante el proceso de división, unidos a través de la maquinaria celular que participa en la transcripción.
Una diana terapéutica contra el ADN extracromosómico en cáncer
El tercer trabajo revela un punto débil relacionado con la transcripción del ADN de los fragmentos extracromosómicos.
Los investigadores observaron que las células con ADN extracromosómico tienen una intensa actividad de transcripción, hasta el punto de generar un “atasco molecular” en el que la maquinaria celular implicada en la transcripción y la replicación del ADN compiten por el mismo espacio. Esta situación crea estrés replicativo en las células. Y como resultado, las células tumorales empiezan a depender de CHK1, una proteína que actúa en puntos de control.
El equipo de investigadores se planteó entonces si la dependencia de CHK1 podía aprovecharse para atacar a las células tumorales. En una primera aproximación, el equipo observó que la inhibición de CHK1 (tanto genética, inactivando el gen, como farmacológica) provocaba la muerte de las células tumorales en tumores con ADN extracromosómico.
Además, un inhibidor específico de CHK1 llamado BBI-2779, que puede ser utilizado como tratamiento oral, consiguió suprimir el crecimiento tumoral en un modelo en ratón de cáncer gástrico. Por una parte, el tratamiento eliminó células tumorales y, por otra, previno la adquisición de resistencia a un tratamiento específico para el tumor.
Primeros ensayos clínicos dirigidos a tratar tumores
Los tres estudios realizados ponen de manifiesto la importancia del ADN extracromosómico en el desarrollo, progresión y resistencia a tratamientos en diversos tipos de cáncer.
Además de ampliar el conocimiento sobre el ADN extracromosómico, los resultados tienen aplicaciones clínicas importantes. La estimación de ADN extracromosómico podría contribuir a clasificar mejor a los pacientes. Por ejemplo, la mayor presencia del ADN extracromosómico en cánceres avanzados y metastásicos sugiere que su presencia está asociada a una menor supervivencia en los pacientes.
Por otra parte, la presencia de ADN extracromosómico también ofrece oportunidades terapéuticas. Dos de los directores del trabajo, Paul Mischel y Howard Chang, han fundado Boundless Bio una empresa enfocada en el desarrollo de terapias para el cáncer basadas en ADN extracromosómico. De momento, los prometedores resultados en los estudios preclínicos en ratón obtenidos con el inhibidor de CHK1 han impulsado el inicio de dos ensayos clínicos en pacientes con tumores sólidos avanzados o con metástasis. En estos ensayos se administrará un inhibidor de CHK1 en combinación con otras terapias dirigidas.
“Hemos aprendido lecciones fundamentales sobre qué pacientes de cáncer están afectados y qué genes o secuencias de ADN se encuentran en los ADNs extracromosómicos”, ha señalado Mischel. “Identificamos los antecedentes genéticos y las firmas mutacionales que nos dan pistas sobre cómo se originan y prosperan los cánceres”.
Artículos científicos:
Hung, K.L., Jones, M.G., Wong, I.TL. et al. Coordinated inheritance of extrachromosomal DNAs in cancer cells. Nature 635, 201–209. 2024. DOI: https://doi.org/10.1038/s41586-024-07861-8
Tang, J., Weiser, N.E., Wang, G. et al. Enhancing transcription–replication conflict targets ecDNA-positive cancers. Nature 635, 210–218. 2024. DOI: https://doi.org/10.1038/s41586-024-07802-5
Bailey, C., Pich, O., Thol, K. et al. Origins and impact of extrachromosomal DNA. Nature 635, 193–200. 2024. https://doi.org/10.1038/s41586-024-08107-3
Otras fuentes:
Revolutionsing four understanding of ecDNA. https://www.cancergrandchallenges.org/ecdna
Cracking the code of DNA circles in cancer, Stanford Medicine-led team uncovers potential therapy. https://med.stanford.edu/news/all-news/2024/11/ecdna-cancer.html
eDyNAmiC. https://www.cancergrandchallenges.org/edynamic
ClinicalTrials: https://clinicaltrials.gov/search?term=Boundless%20Bio
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesa nuestra formación, como el “Máster de Medicina de Precisión y Genética Clínica“, o el “Experto Universitario en Oncogenética“.



