Amparo Tolosa, Genética Médica News

En los últimos años la tecnología CRISPR de edición genómica ha pasado de ser una herramienta con gran potencial a situar a los investigadores a un paso de poder curar múltiples enfermedades genéticas.
Ya desde sus inicios como herramienta para modificar el genoma, en 2012, el sistema CRISPR prometía ser muy versátil. Los investigadores confiaban en poder adaptarlo a diferentes objetivos, desde modificar de forma precisa el ADN a introducir cambios en el epigenoma, ya fuera en una única posición del genoma o en diferentes localizaciones a la vez. Muchas de las promesas se han cumplido. Y desde esta semana ya se pueden añadir dos variaciones más de esta cirugía molecular para el material hereditario.
Investigadores del Broad Institute del Instituto de Tecnología de Massachusetts y de la Universidad de Harvard han publicado dos trabajos en los que se ha adaptado el sistema CRISPR para editar el ARN y ADN de una nueva forma. En ambos casos, la modificación de la secuencia no se lleva a cabo cortando el material hereditario y aprovechando los mecanismos de reparación de la célula, como hace el sistema CRISPR clásico, sino que se modifican unidades concretas del ADN y del ARN.
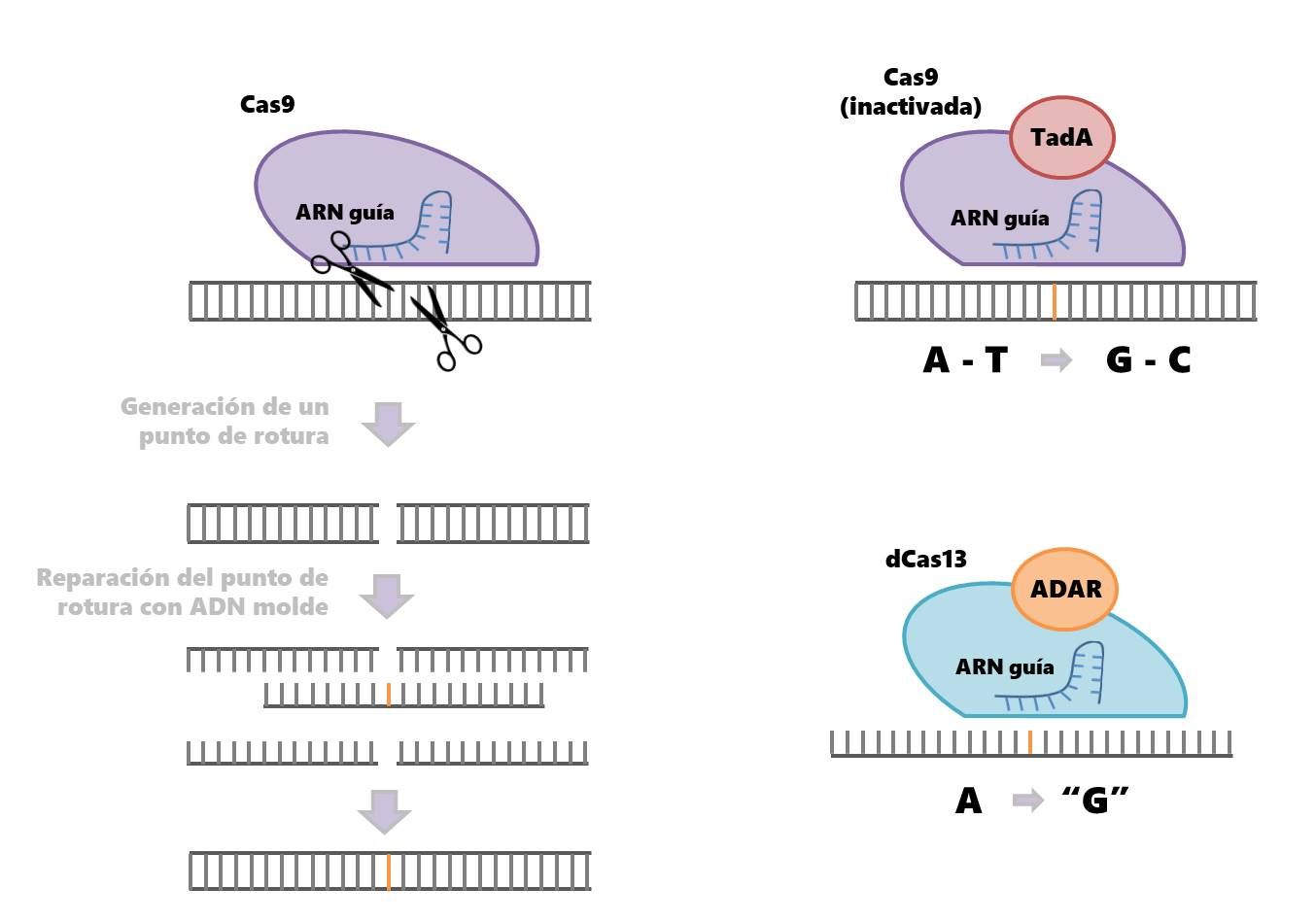
El sistema CRISPR tradicional consta de dos elementos principales, una enzima nucleasa que corta el ADN y un ARN guía que posiciona a la nucleasa en la localización del genoma que se desea modificar. Una vez en esta posición, la nucleasa corta la doble cadena del ADN generando un punto de rotura. Los mecanismos de reparación de la propia célula localizan el daño en el ADN y se encargan de restaurarlo. Sin embargo, en ocasiones estos mecanismos “se equivocan” y generan un cambio. Esta aproximación es especialmente útil cuando se quiere inactivar un gen. Sin embargo, si lo que se quiere es corregir una mutación patológica, el procedimiento es más complicado. Para introducir una modificación concreta, una posibilidad es incorporar un ADN molde a los componentes del sistema, que pueda ser utilizado por los mecanismos de reparación del ADN dirigidos por homología para reparar el ADN. Sin embargo, este método funciona únicamente (y de forma limitada) en el caso de que las células estén dividiéndose, por lo que no se puede utilizar en células ya diferenciadas como las musculares o las neuronas.
Las dos nuevas herramientas CRISPR no generan roturas en el material hereditario, sino que permiten modificar directamente algunas de las bases nucleotídicas o unidades del ARN y ADN. Para ello mantienen uno de los elementos del sistema, el ARN guía, y cambian o adaptan la nucleasa por enzimas capaces de modificar las bases nucleotídicas de forma bioquímica.
El primer estudio, publicado en Science, permite editar el ARN en las células. En este caso, en lugar de utilizar Cas9, la nucleasa habitual que reconoce y corta ADN, los investigadores diseñaron una nueva versión de una nucleasa llamada dCas13. Normalmente, dCas13 reconoce y corta el ARN. Sin embargo, el equipo modificó la enzima para que pudiera ser capaz de unirse al ARN pero no cortarlo. Además, los investigadores fusionaron la variante de dCas13 a ADAR2 una enzima capaz de modificar la adenosina (A) de los transcritos de ARN en Inosina (I) nucleósido que mimetiza a la guanosina.
REPAIR, nombre por el que han denominado a su aproximación, y que deriva de “Edición del ARN mediante sustitución programable de A a I”, en sus siglas en inglés, funciona de la siguiente forma: en primer lugar, gracias al ARN guía el complejo dCas13-ADAR2 reconoce los transcritos de ARN frente a los que está dirigido; a continuación, gracias a la actividad de dCas13 el complejo se une al ARN; por último, mediante la acción de ADAR2 la adenina objetivo es modificada a inosina.
La modificación de guanina (G) a adenina (A) es muy común en enfermedades humanas y está implicada en diferentes casos de epilepsia, distrofia muscular de Duchenne o en Parkinson. Por esta razón resulta muy interesante obtener un método para modificar este cambio en concreto.
Una vez diseñado y confirmado el funcionamiento, los investigadores lo optimizaron para aumentar su especificidad (y evitar mutaciones no deseadas) y facilitar su liberación al interior de las células. Además, para demostrar la utilidad de esta aplicación, el equipo generó células con mutaciones de G a A responsables de diabetes nefrogénica ligada al X (en el gen AVPR2) y anemia de Fanconi (en el gen FANCC) y diseñó sistemas REPAIR dirigidos a las mismas. Tras introducir los componentes del sistema REPAIR en las células, los investigadores consiguieron un 35% y un 23% de corrección de AVPR2 y FANCC respectivamente.
La modificación del ARN ofrece ciertas ventajas frente a la del ADN. Como no se modifica la secuencia original del genoma, los cambios no son permanentes (la vida media de los transcritos de ARN no es muy larga) y el sistema es más susceptible de optimizarse o revertirse.
Si bien en la actualidad REPAIR únicamente puede convertir A en I, los investigadores confían ampliar la diversidad de modificaciones mediante la fusión de Cas13 a otros dominios de edición del ARN.
“La capacidad para corregir mutaciones causantes de enfermedades es uno de los principales objetivos de la edición de genomas,” señala Feng Zhang, miembro del Broad Institute, investigador en el MIT y director del trabajo. “Hasta ahora hemos conseguido mucho en cuanto a inactivar genes, pero recuperar realmente la función proteica perdida es mucho más desafiante. Esta nueva capacidad para editar el ARN abre más oportunidades para recuperar la función y tratar muchas enfermedades en casi cualquier tipo de célula.”

De forma similar pero independiente, el segundo estudio, publicado en Nature muestra cómo es posible modificar los emparejamientos de bases A-T en G-C de la doble hélice de ADN sin llevar a cabo ningún corte en la molécula del ácido nucleico.
Los investigadores responsables de este trabajo ya habían conseguido hace un año modificar citosinas (C) en timinas (T) o guaninas en adeninas. Lo habían conseguido diseñando un sistema CRISPR en el que habían inactivado Cas9 y habían añadido un módulo proteico a la enzima, consistente en la proteína APOBEC1, que puede activar los cambios necesarios para estas modificaciones.
APOBEC1 existe en la naturaleza. Sin embargo, hasta el momento no se había identificado ninguna enzima capaz de modificar los pares A-T en G-C en el ADN, lo que suponía una gran limitación para diseñar un sistema CRISPR que permitiera esa modificación. Y como no existía, los investigadores la crearon. ¿Cómo? Ejerciendo presión evolutiva a través de diferentes generaciones de bacterias hasta obtener un mutante de la proteína TadA (que normalmente modifica el ARN) que modificara el ADN.
Una vez diseñada la enzima capaz de inducir el cambio de A a G en el ADN, los investigadores la fusionaron con la nucleasa Cas9 inactivada para completar el sistema, de forma que junto con un ARN guía permitiera inducir cambios de alta precisión en el genoma. Al igual que en el trabajo de Zhang, una vez optimizado el método, los investigadores evaluaron su eficacia para introducir cambios que revirtieran mutaciones responsables de enfermedades. En este caso, el equipo consiguió reparar mutaciones patológicas T-A a C-G en los promotores de dos genes que codifican para la hemoglobina fetal y producen una enfermedad rara de la sangre, así como revertir una mutación en el gen HFE que da lugar a la hemocromatosis hereditaria. “Hemos desarrollado un nuevo editor de bases, una maquina molecular, que puede corregir mutaciones en el genoma de las células vivas de forma programable, irreversible, eficiente y limpia,” señala David Liu, profesor de la Universidad de Harvard e investigador en el Broad Institute y el Howard Hughes Medical Institute, y director del trabajo.
Al conseguir modificar el par A-T en G-C en el ADN, ya es posible modificar las cuatro posibles transiciones (C a T, A a G, T a C y G a A) en el genoma con herramientas de alta precisión.
Los investigadores reconocen que todavía queda mucho trabajo hasta poder convertir estas nuevas tecnologías de edición del genoma en herramientas clínicas. Sin embargo, las primeras pruebas de concepto en células son muy prometedoras. “Crear una máquina que lleva a cabo el cambio genético que necesitas para tratar una enfermedad es un importante paso hacia adelante, pero es únicamente una parte de lo que se necesita para tratar a un paciente,” manifiesta Liu. “Todavía tenemos que introducir la máquina, tenemos que comprobar su seguridad y tenemos que evaluar sus efectos beneficiosos en animales y pacientes y compararlos frente a los posibles efectos colaterales. Tenemos que hacer muchas cosas. Pero tener la máquina es un buen principio.”
Referencias:
Gaudelli NM, et al. Programmable base editing of A•T to G•C in genomic DNA without DNA cleavage. Nature. 2017. Doi: http://dx.doi.org/10.1038/nature24644
Cox DBT, et al. RNA editing with CRISPR-Cas13. Science. 2017. Doi: http://dx.doi.org/10.1126/science.aaq0180
Fuente:
Researchers engineer CRISPR to edit single RNA letters in human cells. https://www.broadinstitute.org/news/
Researchers extend power of gene editing by developing a new class of DNA base editors. https://www.broadinstitute.org/news/researchers-extend-power-gene-editing-developing-new-class-dna-base-editors



