Genética Médica News
Cambios epigenéticos dirigen algunas metástasis en cáncer
- enero 23, 2017
Amparo Tolosa, Genética Médica News
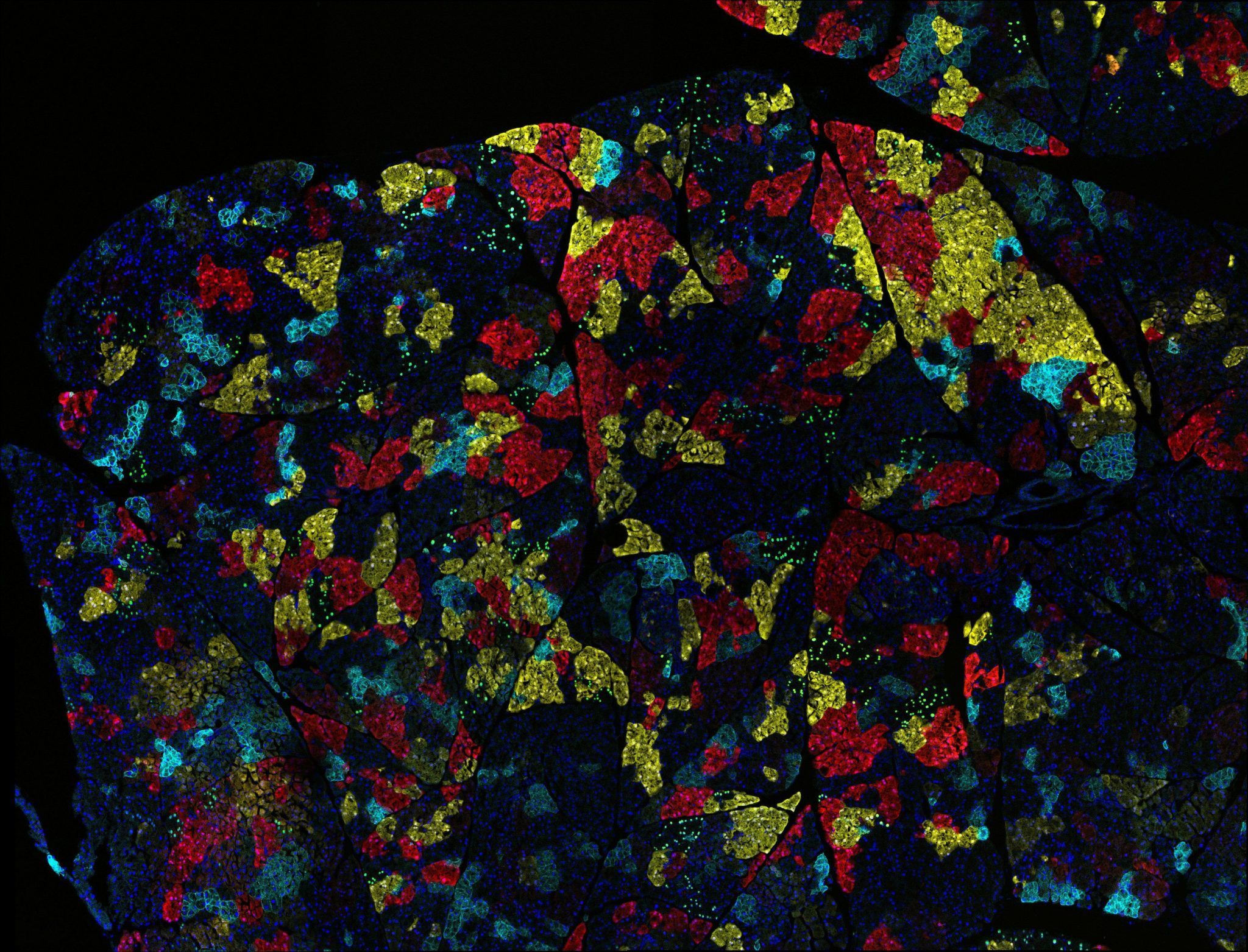
Un estudio dirigido por la Universidad Johns Hopkins acaba de revelar que la propagación de algunos tipos de cáncer puede ser dirigida por cambios epigenéticos que favorecen la supervivencia de las células tumorales.
El carcinoma ductal de páncreas, que representa un 90% de los casos de cáncer páncreas, constituye uno de los tipos de cáncer más agresivos, con un pronóstico muy poco favorable para los pacientes. El análisis genético de las poblaciones de células tumorales que se propagan a partir del tumor primario y dan lugar a la metástasis muestra que estas poblaciones de células comparten los cambios genéticos presentes al inicio del tumor que dirigen el proceso tumoral. Por esta razón, los investigadores se plantearon si podrían existir otros mecanismos, como los epigenéticos, relacionados específicamente con la progresión y metástasis del cáncer de páncreas.
Para resolver esta cuestión, el equipo analizó diferentes clones celulares de los tumores primarios de varios pacientes (que incluían la población original de células que había dado lugar al tumor y otras poblaciones que dieron lugar a las diferentes metástasis), así como muestras de la metástasis ocurrida en los mismos pacientes, y evaluó diferentes parámetros epigenéticos.
De este modo, encontraron que si bien las metástasis locales no mostraban diferencias en el epigenoma respecto a las células del tumor primario, durante la evolución de las metástasis más alejadas del tumor primario se observaba una reprogramación epigenética global. Por ejemplo, las muestras de metástasis al hígado y pulmón mostraban una pérdida progresiva de metilación en las proteínas histonas. Al analizar en detalle las regiones de la cromatina que son reprogramadas en las metástasis distales, los investigadores observaron que estas regiones definen programas de expresión génica relacionados con el proceso tumoral. Además, muchos de los genes afectados proporcionaban ventajas a las células tumorales.
“Lo que encontramos nos sorprendió,” señala Andrew Feinberg, profesor de epigenética en la Universidad John Hopkins. “Cambios en la regulación de los genes, no en la secuencia del ADN o en los genes por sí mismos, eran la fuerza directriz detrás de las metástasis con éxito en nuestros experimentos, y , hasta donde yo sé, este es la primera evidencia experimental a nivel del genoma completo de este fenómeno.”
El siguiente paso de los investigadores fue determinar cuáles son los mecanismos que provocan la reprogramación del epigenoma en las células tumorales que se desplazan a localizaciones más alejadas. Dado que las metástasis distales del carcinoma de páncreas se producen principalmente en órganos que necesitan una fuente importante de azúcar, como el hígado, y con el conocimiento previo de que las células tumorales sufren cambios importantes en su metabolismo a lo largo del proceso tumoral, el equipo se planteó si podría haber cambios metabólicos que indujeran las modificaciones epigenéticas encontradas.
Los investigadores observaron que las células que intervienen en la metástasis del cáncer pancreático requieren un consumo excesivo de glucosa y se preguntaron si podría existir una dependencia de algunas rutas o enzimas del metabolismo de la glucosa. Tras realizar diferentes pruebas bioquímicas, el equipo encontró que las metástasis alejadas del tumor primario procesan la glucosa a través de la ruta molecular de las pentosas fosfato. Además, la inhibición de una enzima responsable de esta ruta, en células tumorales de un paciente, revertía los cambios epigenéticos observados en las células de las metástasis distales, con mínimo efecto sobre el estado epigenético de las metástasis locales. El mismo fármaco utilizado para bloquear la ruta molecular inhibía la formación de tumores por parte de los clones celulares precursores del tumor primario y la metástasis distal.

A partir de la información genética epigenética y bioquímica obtenida en el estudio, los investigadores sugieren un modelo en el que el proceso tumoral del carcinoma ductal de páncreas es iniciado y dirigido por la aparición de ciertas mutaciones seguido de un periodo de evolución clonal que generaría propiedades epigenéticas y metabólicas que confieren ventajas a las células tumorales y favorecen su selección durante el crecimiento invasivo del tumor y la metástasis.
De momento, los investigadores desconocen cómo se activa la ruta de las moléculas pentosa, o cómo la activación de la misma lleva a la remodelación epigenética observada, por lo que todavía es temprano para aplicar el conocimiento obtenido en el trabajo hacia un tratamiento para el cáncer de páncreas. El equipo de investigación está trabajando en ambas áreas.
Por otra parte, aunque el trabajo está enfocado en el cáncer de páncreas, podría ser posible que algunos de los cambios epigenéticos idenfificados en el estudio sean comunes a otros cánceres, lo que abre nuevas vías de investigación en el campo de la oncología. “Aunque no hemos testado esta idea todavía, sabemos que regiones epigenéticas similares son importantes en otros tipos de cáncer, como el cáncer de colon, por lo que es probable que estos cambios epigenéticos a gran escala ocurran en ellos también,” concluye Feinberg.
Referencia: McDonald OG, et al. Epigenomic reprogramming during pancreatic cancer progression links anabolic glucose metabolism to distant metastasis. Nat Genet. 2017 Jan 16. doi: http://dx.doi.org/10.1038/ng.3753
Fuente: Potentially Reversible Changes in Gene Control ‘Prime’ Pancreatic Cancer Cells to Spread. http://www.hopkinsmedicine.org/news/media/releases/potentially_reversible_changes_in_gene_control_prime_pancreatic_cancer_cells_to_spread
Categorías
- Actualidad
- Congresos
- Coronavirus
- CRISPR
- Debates
- Diagnóstico Genético
- Enfermedades Raras
- Entrevistas
- Envejecimiento y longevidad
- Epigenética
- Farmacogenética
- Formación
- Genética del cáncer
- Genética en Cardiología
- Medicina Reproductiva
- Microbiología molecular
- Neurociencia
- Noticias de Genotipia
- Noticias de investigación
- Noticias patrocinadas
- Proyectos
- Reseñas de libros
- Terapia Génica
- Tratamientos
Cursos relacionados
Contacto
¿Quieres publicar con nosotros? ¿Tienes dudas?
Contacta con nosotros de la manera que prefieras y te responderemos a la mayor brevedad.




