Combinando datos clínicos con datos de secuenciación de ARN y variación genética, investigadores del Hospital Monte Sinaí identifican en un reciente estudio, publicado en Nature Cardiovascular Research, docenas de redes de genes que trabajan de forma coordinada y capturan cerca de un 60% del riesgo molecular a desarrollar enfermedad coronaria.
Enfermedades complejas requieren de métodos complejos para investigar los componentes genéticos y moleculares que contribuyen a su desarrollo. Y la enfermedad coronaria es ciertamente compleja: en su desarrollo intervienen factores inflamatorios, factores metabólicos relacionados con la síntesis y transporte de lípidos y factores relacionados con metabolismo de la glucosa, que, además, implican a diferentes órganos y tejidos como el hígado, el páncreas o el tejido adiposo. Estudiar cada uno de estos factores o órganos en el contexto de la enfermedad es útil y ha proporcionado importantes avances en el conocimiento molecular de la enfermedad, entre ellos la identificación de múltiples genes que contribuyen a su desarrollo. El problema es que cada uno de esos genes suele tener un peso pequeño, lo que dificulta poder hacer predicciones precisas o utilizar la información disponible para desarrollar tratamientos.
Ahora, un equipo de investigadores del Hospital Monte Sinaí ha construido un mapa de interacciones entre los genes implicados en la enfermedad coronaria y su actividad en diferentes tejidos en pacientes que proporciona una visión sistémica e integrada de utilidad para la investigación y desarrollo clínico.
“Encontramos que las redes de genes funcionan como patrones de tráfico aéreo. De igual forma que retraso en un aeropuerto en un estado clave puede alterar vuelos en todo el país, un cambio ligero en la actividad de genes clave en un tejido puede alterar la actividad de otros genes en el resto del organismo”, indica Johan LM Bjorkegren, profesor de Genética y Genómica en la Facultad de Medicina del Hospital Monte Sinaí.
Construyendo un mapa génico de la enfermedad coronaria
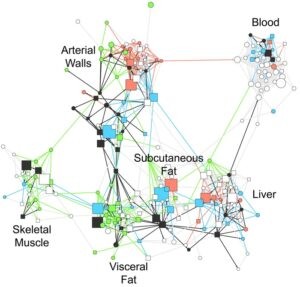
En un primer paso los investigadores analizaron la actividad génica en siete tejidos de 850 personas, 600 de las cuales tenían una enfermedad coronaria. Los tejidos, relevantes para la enfermedad, fueron: sangre, hígado, músculo esquelético, tejido abdominal visceral, y grasa subcutánea, así como dos piezas de pared arterial obtenidas durante cirugía, en el caso de los pacientes. Los participantes formaban parte del estudio STARNET (Atherosclerosis Reverse Network Engineering Task) que se inició hace casi 20 años.
Con los datos de expresión, el equipo identificó módulos de genes que se expresan de forma coordinada e integró esta información con resultados de estudios genéticos y clínicos. Finalmente, el equipo obtuvo y validó 224 redes de genes que se expresan de forma conjunta y actúan a través de diferentes órganos y tejidos para promover el desarrollo de enfermedad coronaria. De estos módulos genéticos 135 operan en un único tipo de tejido, mientras que los otros 89 representan módulos de actividad génica coordinada presente en diferentes tejidos.
La regulación genética de las redes de genes coexpresados explica entre un 54 y un 60% de la variación de la enfermedad coronaria que se puede atribuir a factores genéticos. Este resultado supera el 22% identificado previamente y ofrece utilidad para investigar de forma más precisa los mecanismos que derivan en enfermedad cardiovascular.
Por ejemplo, los investigadores señalan que el módulo 165, que incluye 709 genes, explica un 4.1 de la heredabilidad de la enfermedad coronaria y está altamente asociado a los niveles de colesterol LDL en plasma y la severidad de la enfermedad.
Otro resultado de interés es que la comunicación y coordinación de los módulos genéticos entre los diferentes tejidos está mediada, al menos en parte, por señalización endocrina. Los investigadores han encontrado numerosas señales de factores endocrinos, la mayoría no caracterizados todavía, en los módulos genéticos que están activos en diferentes tejidos. En algunos casos, como en el módulo GRN78, por ejemplo, han identificado al tejido adiposo como la fuente de señales endocrinas. “Facilitando la comunicación entre los tejidos metabólicos y la pared arterial, estos factores [endocrinos] son probablemente contribuyentes clave para la enfermedad cardiovascular y el desarrollo de enfermedad coronaria además de que podrían constituir dianas potenciales para terapias futuras” comentan los investigadores.
El equipo dirigido por Bjorkegren ha desarrollado una página web donde han integrado los resultados y donde otros investigadores pueden consultar en qué módulos genéticos se localizan los genes identificados en estudios de asociación. “Esta nueva información patofisiológica debería ser útil para la comunidad de investigadores y facilitará la interpretación de los estudios de asociación de genomas completos, en los que la mayoría de los SNPs identificados y genes candidatos asociados carecen del contexto multiórganico y mecanístico en el que operan”, concluyen los investigadores en el estudio. “Esperamos que este estudio proporcione a los investigadores las herramientas que necesitan para reducir la carga de la enfermedad coronaria en todo el mundo”, señala Bjorkegren.
Referencia: Koplev, S., Seldin, M., Sukhavasi, K. et al. A mechanistic framework for cardiometabolic and coronary artery diseases. Nat Cardiovasc Res 1, 85–100 (2022). https://doi.org/10.1038/s44161-021-00009-1
Fuentes:
Schmidt, H.H.H.W., Menche, J. The regulatory network architecture of cardiometabolic diseases. Nat Genet 54, 2–3 (2022). https://doi.org/10.1038/s41588-021-00994-w
Could Gene Networks Resembling Air Traffic Explain Arteriosclerosis? https://www.mountsinai.org/about/newsroom/2022/could-gene-networks-resembling-air-traffic-explain-arteriosclerosis
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesa nuestra formación, como el “Máster de Medicina de Precisión y Genética Clínica“, o el “Experto Universitario en Cardiogenética“.



