Genética Médica News
Papel diferencial de las isoformas de HP1 en la organización y estructura de la heterocromatina
- diciembre 13, 2017
Alejandro Vaquero y Laia Bosch-Presegué
Laboratorio de Biología de la Cromatina, Programa de Biologia y Epigenética del Cáncer (PEBC), Institut d’Investigació Biomèdica de Bellvitge (IDIBELL), Barcelona, España
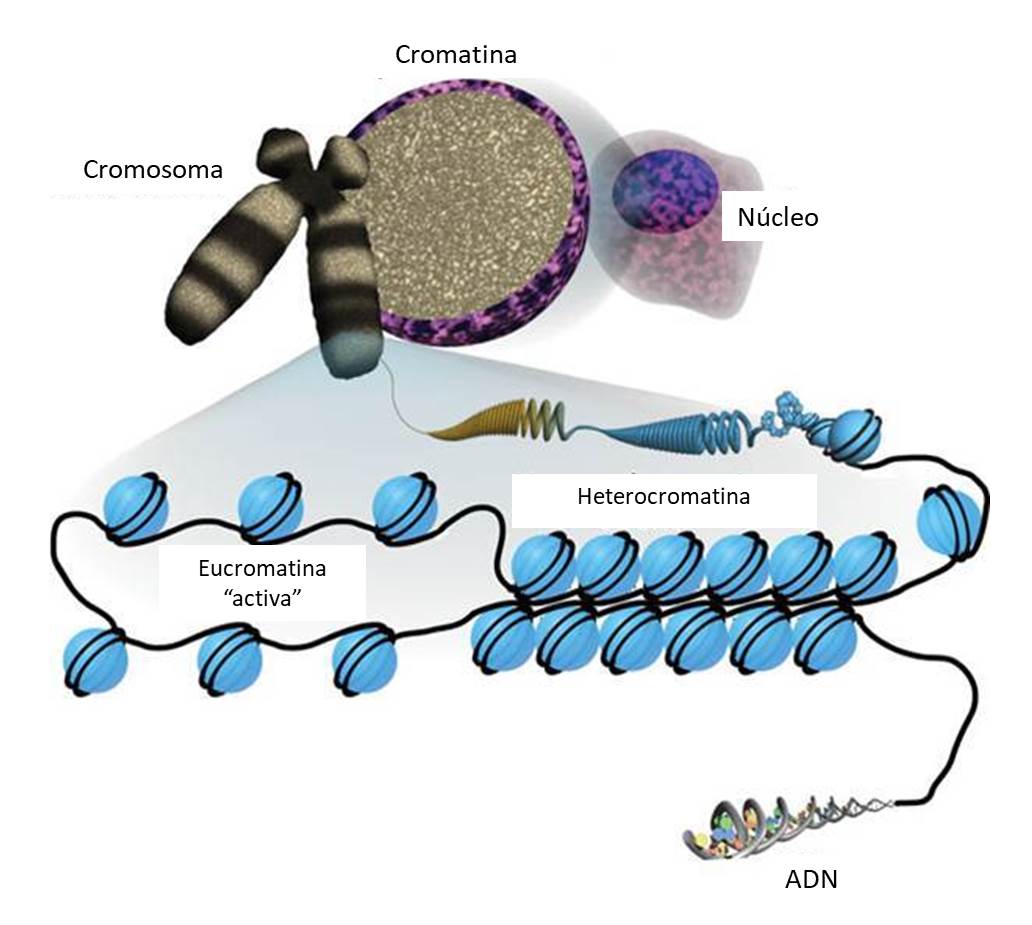
El material genético se organiza dentro del núcleo celular en forma de cromatina, una estructura constituida principalmente por moléculas de ADN asociadas a histonas y otras proteínas. La cromatina se organiza en sucesivos niveles de compactación que van desde el nucleosoma, la unidad estructural básica de la cromatina, a la forma más compactada que se encuentra en los cromosomas metafásicos. Cuando la célula no se está dividiendo, la cromatina se encuentra en dos formas de compactación claramente diferenciables: eucromatina, cromatina menos compactada y transcripcionalmente activa y heterocromatina, más compactada y transcripcionalmente inactiva. Las transiciones entre estos distintos estados de compactación están regulados por una serie de mecanismos que incluyen modificaciones postraduccionales de histonas, metilación del ADN, proteínas estructurales no histónicas, factores de transcripción y actividades de remodelación de la cromatina.
Al mismo tiempo la heterocromatina se puede clasificar en heterocromatina facultativa y heterocromatina constitutiva. La heterocromatina facultativa se encuentra en regiones ricas en genes y puede convertirse en eucromatina para permitir la expresión de los genes en tipos celulares específicos o en determinados estadios del desarrollo. La heterocromatina constitutiva se encuentra permanentemente silenciada y tiene una función básicamente estructural, y está asociada principalmente a regiones centroméricas o teloméricas, importantes para la protección de los extremos de los cromosomas y la separación de las cromatidas en la mitosis.
Uno de los componente estructurales clave de la heterocromatina es la proteína heterocromatina 1 (HP1) que participa en el establecimiento y la propagación de ésta. Estudios recientes sugieren que el papel de HP1 en la estabilidad del genoma va más allá de la estructura de la heterocromatina, ya que desempeña un papel importante en la expresión génica, replicación y reparación del ADN, ciclo celular, diferenciación celular y desarrollo (Maison and Almouzni, 2004). Existen tres variantes o isoformas diferentes de HP1 (HP1α, HP1β y HP1γ) en mamíferos que presentan un elevado grado de conservación de secuencia y que se había postulado que desempeñan en gran parte una actividad redundante, es decir, equivalente independientemente de la variante.
En nuestros trabajos, recientemente publicados en Cell Reports y Epigenetics, hemos estudiado la función de las variantes de HP1 en la estructura de la cromatina pericéntrica (PCH), la que delimita la zona del centrómero o punto de unión entre las cromátidas hermanas en un cromosoma. En el primer estudio, publicado a principios de año por la revista Epigenetics (Raurell-Vila et al., 2017) , se demostró que, a diferencia de lo que se pensaba, bajo condiciones de estrés oxidativo (involucrado en muchas enfermedades, como cáncer, Parkinson y Alzhéimer, así como en envejecimiento) las tres variantes de HP1 juegan papeles diferentes en el mantenimiento de la estabilidad y el establecimiento de los diferentes niveles de compactación de la cromatina. Específicamente, las tres variantes establecen relaciones funcionales diferenciales con Suv39h1, una metiltransferasa de histonas específica de la marca epigenética H3K9, clave en la formación y el mantenimiento de la PCH.
En este nuevo estudio publicado en Cell Reports (Bosch-Presegué et al., 2017), se profundiza en el papel regulatorio de HP1α, HP1β y HP1γ en relación a la PCH. La alteración de la estructura y organización de la PCH se ha relacionado con defectos de progresión del ciclo celular, daño del ADN, aberraciones cromosómicas, apoptosis, cáncer y envejecimiento (Benayoun et al., 2015; Carone y Lawrence, 2014). En una serie de experimentos con células primarias derivadas de modelos de ratones knockout para cada una de las isoformas de HP1, se observa que HP1α y β tienen un papel específico en la estabilidad genómica. Al estudiar las anomalías mitóticas asociadas a estas células, observamos que la pérdida de HP1α y β resulta en un incremento en el número de aberraciones si se compara con las aberraciones relacionadas con la perdida de γ o con las células de genotipo salvaje. Además, las aberraciones encontradas en las células deficitarias para HP1α y β son sorprendentemente diferentes. La pérdida de HP1α resulta en problemas de unión simultánea del cinetocoro a los dos polos del huso mitótico mientras que la pérdida de HP1β resulta en defectos de multipolaridad del huso mitótico, que se han asociado con problemas de descompactación de los cromosomas.
La pérdida específica de HP1α daría lugar a una mayor presencia de las marcas epigenéticas H4K20me3 y H3K27me3, directamente vinculadas a la hipercompactación de la cromatina. HP1α reclutaría CTCF, factor de transcripción clave en la regulación de la arquitectura de la cromatina, en sitios específicos de la PCH y conjuntamente mantendrían la estructura interna de esta mediante el control de la distribución de las marcas histónicas H4K20me3 y H3K27me3. Por el contrario, los datos obtenidos sugieren que HP1β tendría un papel contrapuesto a HP1α en relación a H4K20me3 y H3K27me3 y que la pérdida de HP1β daría lugar a un aumento de CTCF en las regiones de PCH y a una descompactación de la cromatina. HP1β participaría en la restricción de localización de CTCF y en el control de los límites de la cromatina.
Este hallazgo amplía el conocimiento actual de la organización del genoma aportando una nueva perspectiva en cuanto al papel de las isoformas de HP1 y su relación funcional con la estructura de la heterocromatina. Los resultados obtenidos sugieren que cada isoforma tiene un papel específico y que el balance funcional entre las diferentes isoformas de HP1 es clave para el mantenimiento de la estabilidad genómica. Teniendo en cuenta que las alteraciones en la PCH se han relacionado con defectos en el ciclo celular, daños en el ADN, aberraciones cromosómicas, muerte celular, cáncer y envejecimiento, ambos estudios abren nuevas vías no solo en el conocimiento básico del genoma, sino también hacia una mejor comprensión de estos procesos vinculados a numerosas enfermedades.
Referencias:
Bosch-Presegué L, et al. Mammalian HP1 Isoforms Have Specific Roles in Heterochromatin Structure and Organization. Cell Rep. 2017 Nov 21;21(8):2048-2057. doi: 10.1016/j.celrep.2017.10.092.
Raurell-Vila H, et al. An HP1 isoform-specific feedback mechanism regulates Suv39h1 activity under stress conditions. Epigenetics. 2017 Feb;12(2):166-175. doi: 10.1080/15592294.2016.1278096.
Bibliografía:
Benayoun BA, et al. Epigenetic regulation of ageing: linking environmental inputs to genomic stability. Nat Rev Mol Cell Biol. 2015 Oct;16(10):593-610. doi: 10.1038/nrm4048.
Maison C, Almouzni G. HP1 and the dynamics of heterochromatin maintenance. Nat Rev Mol Cell Biol. 2004 Apr;5(4):296-304.
Carone DM, Lawrence JB. Heterochromatin instability in cancer: from the Barr body to satellites and the nuclear periphery. Semin Cancer Biol. 2013 Apr;23(2):99-108. doi: 10.1016/j.semcancer.2012.06.008.
Categorías
- Actualidad
- Congresos
- Coronavirus
- CRISPR
- Debates
- Diagnóstico Genético
- Enfermedades Raras
- Entrevistas
- Envejecimiento y longevidad
- Epigenética
- Farmacogenética
- Formación
- Genética del cáncer
- Genética en Cardiología
- Medicina Reproductiva
- Microbiología molecular
- Neurociencia
- Noticias de Genotipia
- Noticias de investigación
- Noticias patrocinadas
- Proyectos
- Reseñas de libros
- Terapia Génica
- Tratamientos
Cursos relacionados
Contacto
¿Quieres publicar con nosotros? ¿Tienes dudas?
Contacta con nosotros de la manera que prefieras y te responderemos a la mayor brevedad.




