Genética Médica News
Identificación funcional de nuevos genes reguladores del trasplante de médula ósea
- marzo 11, 2016
Miguel Ganuza
Departamento de Hematología, St. Jude Children’s Research Hospital (Memphis, USA)
La Hematopoyesis es un proceso increíblemente activo que permite producir, jerárquicamente, las distintas células sanguíneas a partir de un ancestro común, denominado Célula Madre Hematopoyética (HSC, del inglés Hematopoietic Stem Cell).
Cada día, en la médula ósea de un ser humano adulto se generan alrededor de un trillón de células. Ésta, y otras características excepcionales han permitido el trasplante de HSC. Miles de pacientes se han beneficiado en todo el mundo de esta terapia celular durante los últimos 45 años. Este tratamiento permite tratar diferentes tipos de enfermedades hematológicas (incluyendo ciertas leucemias) y es esencial para la recuperación de pacientes después de haber sido sometidos a quimioterapia. Es, de hecho, la única cura para tratar ciertas enfermedades asociadas con un fallo en la médula ósea o en el sistema inmune.
Una de las limitaciones en el trasplante de médula es encontrar un donante adecuado. Muchos pacientes fallecen durante el proceso de búsqueda y, a veces, se enfrentan con el riesgo de sufrir complicaciones derivadas de un trasplante subóptimo (sufriendo el ataque de las células transplantadas al receptor del transplante, GVHD, del inglés Graft Versus Host Disease).
Otro problema es el número de células necesarias para realizar un trasplante. Actualmente, a pesar de los continuos y extensos esfuerzos, la expansión in vitro de las HSC no es posible, y sólo se pueden mantener en cultivo por un periodo de tiempo reducido, antes de que pierdan sus propiedades originales, de forma que ya no serían capaces de regenerar el sistema hematopoyético del receptor.
Nuevas tecnologías (como la tecnología de iPS cells, del inglés induced Pluripotent Stem Cells) han permitido la obtención de células madre pluripotentes mediante la reprogramación de distintos tipos de células diferenciadas. Esto abre la posibilidad de derivar distintos tipos celulares a partir de otros tipos celulares sanos del mismo paciente (evitando cualquier tipo de rechazo). Actualmente, no es posible generar células madre hematopoyéticas in vitro a partir de células madre pluripotentes o de ningún otro tipo celular. Esto, junto a la ya mencionada incapacidad de las HSC para mantener sus características cuando son cultivadas in vitro, sigue haciendo de estas células un recurso escaso.
Cuando se realiza un trasplante de médula, las HSC tienen que interaccionar de manera adecuada con el entorno celular (nicho) y establecerse de forma estable; permitiendo que puedan dividirse, diferenciarse y generar todas las células de la sangre, para reconstituir el sistema hematopoyético completo del receptor.
Una de las maneras en las que se puede mejorar los actuales protocolos de trasplante, es conociendo cuáles son los mecanismos moleculares que tienen lugar durante este proceso. Nuestro estudio se centra en este aspecto.
A partir de diferentes bases de datos disponibles [Hematopoietic Fingerprints (Chambers et al., 2007); the Immunological Genome Project (Heng et al., 2008) y, Stem Site (McKinney-Freeman et al., 2012)], identificamos 51 genes candidatos a tener un papel en el trasplante de células madre hematopoyéticas.
Se utilizó la tecnología de shRNA (del inglés, short-hairpin RNAs) para disminuir individualmente la expresión de cada uno de estos genes en células madre hematopoyéticas de ratón. Estas células fueron infectadas con lentivirus para permitir la expresión de estos shRNA y, así, reducir los niveles de ARN mensajero (ARNm) de estos genes. A continuación, estas células HSC fueron trasplantadas en ratones receptores para evaluar su efecto durante el trasplante.
El análisis de la capacidad de repoblar de estas células, con niveles reducidos de ARNm para estos genes (al menos en un 70%), mostró que 17 de ellos tienen un papel en el trasplante de médula ósea, afectando a la capacidad de las células HSC para repoblar de forma eficiente las distintas poblaciones sanguíneas del ratón receptor.
La reducción individual de los niveles de ARNm de 15 de estos genes en HSC (Arhgef5, Cadps2, Crispld1, Emcn, Foxa3, Fstl1, Glis2, Gpr56, Myct1, Nbea, P2ry14, Smarca2, Sox4 y Gpr56) provocó una disminución de la capacidad de repoblar la médula ósea, indicando que estos genes son reguladores positivos para el trasplante.
En cambio, la expresión de otros dos genes (Armcx1 y Gprasp2) es perjudicial para la capacidad repobladora de las HSC, ya que la reducción de sus niveles provoca un aumento en su potencial repoblador.
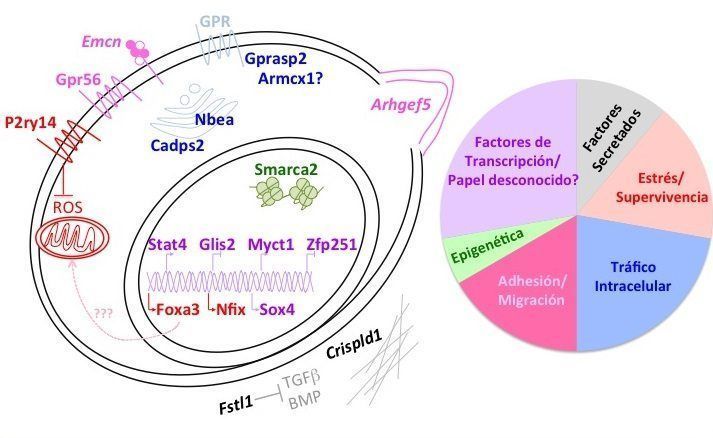
Los genes identificados ponen de manifiesto procesos moleculares y celulares involucrados en el trasplante de HSC, algunos de los cuales no habían sido estudiados en este contexto. Un grupo de ellos estaría implicado en el transporte de vesículas celulares y en la regulación de proteínas receptoras en la superficie celular (como Nbea, Cadsps2, Armcx1 y Gprasp2). Estos genes podrían estar regulando las interacciones de las HSC con las distintas células del nicho, así como la transducción de señales críticas para su supervivencia. Otro conjunto de genes incluye proteínas secretadas (Fstl1 y Crispld1). Crispld1 codifica una proteasa que actuaría sobre la matriz extracelular. Fstl1 es un antagonista de TGFβ y de los factores BMP, que podría inhibir estas señales inhibitorias.
Por otro lado, Arhgef5 está implicado en la formación de podosomas, que a su vez son importantes en la migración y adhesión celular.
Nuestro trabajo, además, implica por primera vez los genes Foxa como reguladores de las HSC. Así, Foxa3 tendría un papel en la regulación de la respuesta de las células madre hematopoyéticas a estrés.
Todo ello pone de manifiesto la importancia de la interacción de las células trasplantadas con el nicho en la médula ósea y, quizá, la cooperación entre ambos para formar un entorno adecuado que permita la supervivencia, viabilidad y funcionalidad a largo plazo de las HSC trasplantadas.
Referencia:
Holmfeldt P, Ganuza M, et al. Functional screen identifies regulators of murine hematopoietic stem cell repopulation. J Exp Med. 2016 Feb 15. pii: jem.20150806
Bibliografía:
McKinney-Freeman S, et al. The transcriptional landscape of hematopoietic stem cell ontogeny. Cell Stem Cell. 2012 Nov 2. doi: 10.1016/j.stem.2012.07.018.
Chambers SM, et al. Hematopoietic fingerprints: an expression database of stem cells and their progeny. Cell Stem Cell. 2007 Nov 1. doi: 10.1016/j.stem.2007.10.003.
Heng TS, et al. The Immunological Genome Project: networks of gene expression in immune cells. Nat Immunol. 2008 Oct 9. doi: 10.1038/ni1008-1091.
Categorías
- Actualidad
- Congresos
- Coronavirus
- CRISPR
- Debates
- Diagnóstico Genético
- Enfermedades Raras
- Entrevistas
- Envejecimiento y longevidad
- Epigenética
- Farmacogenética
- Formación
- Genética del cáncer
- Genética en Cardiología
- Medicina Reproductiva
- Microbiología molecular
- Neurociencia
- Noticias de Genotipia
- Noticias de investigación
- Noticias patrocinadas
- Proyectos
- Reseñas de libros
- Terapia Génica
- Tratamientos
Cursos relacionados
Contacto
¿Quieres publicar con nosotros? ¿Tienes dudas?
Contacta con nosotros de la manera que prefieras y te responderemos a la mayor brevedad.




